Publié le 01 nov 2010Lecture 14 min
Les besoins en vitamine D chez l’enfant
M.DEKER, Paris
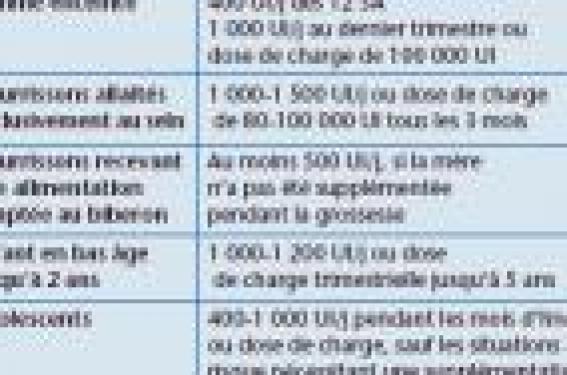
La lutte contre le rachitisme infantile a conduit à institutionnaliser la supplémentation en vitamine D puis l’enrichissement des laits infantiles. Un autre objectif de la supplémentation est d’optimiser la minéralisation osseuse et d’intervenir sur la survenue de l’ostéoporose en fin de vie. Les besoins en vitamine D sont déterminés par de nombreux paramètres : âge, ensoleillement, phototype, habitus, etc. Il existe en outre un polymorphisme du récepteur de la vitamine D qui pourrait intervenir sur la taille et sur la densité osseuse.
La saga de la prévention du rachitisme par la vitamine D (1) Le rachitisme a été décrit au XVIIe siècle et a connu son apogée à la fin du XIXe et au début du XXe siècle, en rapport avec la révolution industrielle et les conditions de vie dans les centres urbains. Deux hypothèses, apparemment contradictoires, ont rapidement été émises : une hypothèse nutritionnelle, formulée par Trousseau, qui montra l’efficacité de l’huile de foie de morue, hypothèse confirmée expérimentalement par Mellanby chez le rat au début du XXe siècle, et qui a conduit à l’isolement de la vitamine D ; et l’hypothèse liée à l’ensoleillement, issue d’un travail réalisé à Varsovie, montrant que le rachitisme était fréquent dans le centre urbain et relativement rare en zone suburbaine. L’apparente contradiction fut ensuite résolue par McCollum en 1925, qui montra que les UVB confèrent une activité vitaminique D en transformant le 7-déhydrocholestérol en cholécalciférol (vitamine D3) et l’ergostérol en ergocalciférol (vitamine D2). Le bénéfice conjoint de l’ensoleillement et d’un apport en huile de foie de morue a été confirmé par Elliot en 1925, dans une étude considérée comme fondatrice par les Américains ; chez 116 nourrissons recevant de l’huile de foie de morue et régulièrement exposés au soleil pendant le premier mois de vie, comparativement à des nourrissons témoins ne bénéficiant pas de ces mesures, le taux de rachitisme n’a été que de 4 %, alors qu’un tiers des témoins en étaient affectés. De là, les autorités américaines ont préconisé un enrichissement systématique du lait en vitamine D, dès 1934, ce qui a conduit à une quasi-disparition du rachitisme. En France, opposée à l’enrichissement du lait, la prévention a reposé sur l’huile de foie de morue puis sur la vitamine D, jusqu’en 1992. La prévalence du rachitisme évaluée dans deux villes françaises à la fin des années 1950 était particulièrement élevée : 17 % des enfants hospitalisés à Lyon, 12 % à Marseille. Cela a conduit à la publication d’une circulaire officielle, émise en 1963 et renouvelée en 1971, précisant les modalités de la prophylaxie de cette maladie par la vitamine : – 1 000 à 1 500 UI/j chez le nourrisson normal, selon son exposition solaire ; – 2 500 UI/j si la peau est très pigmentée ; – 1 500 UI/j chez le prématuré ; – prévention quotidienne jusqu’à 2,5 ans, hivernale de 2,5 à 6 ans ; – possibilité de substituer une prévention par dose de charge trimestrielle ou semestrielle à la prévention quotidienne. Malgré cette circulaire, le rachitisme a persisté à des taux anormalement élevés, comme l’a montré une enquête INSERM réalisée auprès de nombreux hôpitaux français dans une dizaine de villes, en 1988-1990. Pour la seule ville de Nancy, les médecins de PMI ont évalué à 83 % l’observance régulière de la prophylaxie vitaminique ; en fin d’hiver, 39 % des nourrissons avaient un taux de 25-OH-D ≤ 8 ng/ml, avec des valeurs extrêmement dispersées (de 0,5 à 40,5 ng/ml), alors qu’en fin d’été, 3 % avaient des taux < 10 ng/ml, avec des valeurs peu dispersées ; aucun enfant n’avait des valeurs > 40 ng/ml. Cette étude confirmait la médiocre observance de la prévention du rachitisme dans un milieu socioéconomique moyen et l’importance de l’ensoleillement. Le rachitisme a presque disparu aujourd’hui en France L’enrichissement des laits infantiles en vitamine D n’a reçu l’agrément ministériel qu’en 1992, ce qui a conduit à une baisse spectaculaire des cas de rachitisme carentiel. En 2001, une autorisation d’enrichissement de tous les laits en vitamine D (400 UI/l) a été obtenue devant le constat que les adultes souffrent également d’un déficit en vitamine : outre de très faibles taux sériques de vitamine D, les concentrations sériques de parathormone (PTH) sont très élevées, ce qui traduit une réaction de l’organisme, qui prélève du calcium sur l’os. Une enquête réalisée en 2005 par E. Mallet par courrier électronique a confirmé la quasi-disparition des cas de rachitisme du nourrisson en France. La question posée par la vitamine D aurait pu être considérée comme résolue si un regain d’intérêt n’était advenu depuis la fin des années 1990, et ce, pour plusieurs raisons : – la réapparition du rachitisme aux États-Unis chez les enfants allaités au sein et dans les populations afro-américaines ; – un déficit en vitamine D préoccupant dans d’autres groupes d’âge, en particulier chez les femmes enceintes ; – l’évolution de la définition du déficit en vitamine D depuis que la 25-OH-D est utilisée comme marqueur avec l’appui de la PTH sérique ; – la reconnaissance de l’implication de la vitamine D dans la survenue de pathologies extraosseuses. En France, l’enrichissement des laits infantiles en vitamine D n’a reçu l’agrément ministériel qu’en 1992, entraînant une baisse spectaculaire des cas de rachitisme carentiel. De nouveaux objectifs de la prévention par la vitamine D On a longtemps estimé que des taux sériques de 25-OH-D compris entre 10 et 55 ng/ml étaient satisfaisants pour la prévention du rachitisme et de l’ostéomalacie. À cet objectif premier de la prévention vitaminique s’est ajouté un autre objectif qui est d’optimiser la minéralisation osseuse afin de diminuer le risque fracturaire et de retarder la survenue de l’ostéoporose en fin de vie. Pour ce faire, il faut déterminer le seuil de 25-OH-D permettant de diminuer la PTH à sa valeur la plus basse. L’un des premiers travaux sur ce thème est issu de la cohorte SU.VI. MAX, qui a montré la grande fréquence du déficit en vitamine D chez l’adulte et établi que le seuil de 25-OH-D au-dessous duquel la PTH n’augmente pas est de 31 ng/ml. Cette valeur a été confirmée par d’autres travaux, qui ont précisé plusieurs valeurs seuils : – un seuil de suffisance entre 30 et 50 ng/ml ; – un seuil d’insuffisance entre 21 et 29 ng/ml ; – un seuil de déficit < 21 ng/ml. Chez l’enfant, une majorité d’auteurs s’accordent pour considérer que les valeurs seuils sont équivalentes à celles de l’adulte. Un tiers des enfants ayant des taux de 25-OH-D < 12 ng/ml auraient des signes de rachitisme. Chez l’adolescent, la relation inverse entre les concentrations de vitamine D et de PTH est retrouvée avec un seuil de suffisance légèrement différent, de 25-32 ng/ml et d’insuffisance de 12-20 ng/ml. Toutefois, chez l’enfant en croissance, la signification d’une PTH élevée est plus discutée. Une étude ayant suivi des adolescents supplémentés en calcium et pris en charge à partir du stade 2 de Taner (développement des poils pubiens à la puberté) a, en effet, montré que paradoxalement les enfants ayant des taux de 25-OH-D dans la fourchette normale-faible (de l’ordre de 18 ng/ml) et une PTH élevée ont un meilleur gain de surface osseuse (+8 %) et de densité minérale osseuse (DMO) (+11 %) que les enfants ayant des taux de 25-OH-D élevés à 34 ng/ml. La relation entre vitamine D et PTH paraît donc moins simple chez l’enfant et l’adolescent que chez l’adulte. Il existe peu d’études ayant évalué la relation entre 25-OH-D et statut minéral osseux. Concernant l’os diaphysaire, la DMO est faible pour des taux de 25-OH-D < 10 ng/ml, plus élevée pour des taux > 25 ng/ml. Au niveau de l’os trabéculaire, on ne constate de chute de la DMO que pour des valeurs très basses de 25-OH-D < 8 ng/ml. Les valeurs limites que l’on peut retenir de ces travaux sont : < 6 ng/ml pour les déficits sévères en vitamine D entraînant un rachitisme ; 16 à 18 ng/ml pour des déficits moins sévères pouvant entraîner une hyperparathyroïdie, rarement un rachitisme, et susceptibles de conduire à un défaut de minéralisation ne permettant pas d’atteindre le pic de minéralisation suffisant, et d’entraver la croissance osseuse. Cette situation n’est pas rare en Europe, en hiver et au printemps, périodes durant lesquelles 30 à 50 % des enfants autochtones vivant en Pologne, en Russie, au Danemark et en Finlande sont concernés, et 17 à 35 % des enfants vivant dans des pays de latitude moins élevée, tels que la Grèce, l’Allemagne, la Suisse et la France. Les enfants à la peau plus pigmentée sont encore plus fréquemment touchés (70 % des Asiatiques vivant en Grande-Bretagne ont un déficit vitaminique avec des taux < 20 ng/ml). L’autre objectif de la supplémentation en vitamine D est d’optimiser la minéralisation osseuse et de retarder la survenue de l’ostéoporose en fin de vie. Quels sont les besoins en vitamine D orale ? Pour les déterminer, il faut prendre en compte de nombreux facteurs. Le premier est que la synthèse de 25-OH-D dépend avant tout du niveau de photosynthèse sous l’effet des UVB, lesquels sont facilement arrêtés dans la haute atmosphère en cas d’inclinaison des rayons solaires, et qui varient donc en fonction de la saison. En hiver, en France, il n’y a pas de photosynthèse cutanée de vitamine D. Les UVB sont arrêtés par le brouillard, la pollution, les vitres, les vêtements, les crèmes solaires et la pigmentation cutanée. L’apport de vitamine d’origine alimentaire n’est pas suffisant, car très peu d’aliments en contiennent (poissons gras), à moins d’enrichir les aliments comme les laitages. Il faut aussi tenir compte de l’obésité, qui interfère négativement avec la disponibilité en vitamine D. De même, la moindre efficacité de la vitamine D2 comparativement à la vitamine D3 est toujours discutée. En France, on considère que 400 UI/j sont nécessaires pour atteindre des taux sériques de 25-OH-D > 20 ng/l, et ce, quel que soit l’âge. Les apports nutritionnels recommandés chez les nourrissons, de 1 000 à 1 200 UI/j, peuvent paraître excessifs, mais n’ont jamais conduit au moindre incident. De 1 à 3 ans, la dose recommandée est de 400 UI/j et rien ne justifie qu’elle soit diminuée au-delà de 3 ans. En pratique, il faudrait maintenir une supplémentation hivernale après l’âge de 1 an, sans interruption jusqu’à la fin de la croissance, ou au minimum jusqu’à l’âge de 5 ans avec une reprise à l’adolescence. Par commodité et pour favoriser l’observance, il est possible de recourir à des doses de charge trimestrielles administrées en octobre, janvier et avril, par exemple (tableau). Aucun risque d’hypervitaminose n’est à craindre, les apports maximaux admis aux États-Unis étant de 2 000 UI/j. Le taux sérique maximal de 25-OH-D se situe entre 80 et 100 ng/ml, mais il n’y a pas d’hypervitaminose D réellement documentée à moins que les taux sériques ne dépassent 150 ng/ml. Conclusion La satisfaction des besoins en vitamine D reste mal assurée en France et l’application des recommandations officielles est toujours insuffisante. La supplémentation en vitamine D est efficace et sans risque. Outre son intérêt pour la santé osseuse, la vitamine D présente un intérêt en prévention de plusieurs pathologies, ne serait-ce que la survenue d’un diabète de type 1 chez l’enfant. Variants du récepteur de la vitamine D, croissance et masse osseuse L’action de la vitamine D est médiée par un récepteur intracellulaire, VDR, qui, à l’instar des membres de la superfamille des récepteurs des hormones stéroïdes, opère comme un facteur de transcription en se liant directement à l’ADN. Le gène du VDR, situé sur le chromosome 12, comporte de nombreux polymorphismes qui ont fait l’objet d’études en relation avec le métabolisme phosphocalcique, l’ostéoporose, la lithiase rénale, l’hyperparathyroïdie, les anomalies de la croissance, la minéralisation osseuse, les désordres immunitaires et certains cancers (mélanome, cancers colorectaux, cancer de la prostate). Sur près de 300 variants génétiques décrits, seuls les quatre premiers découverts, localisés dans la région codante du gène, ont fait l’objet d’études. Leur fonction est néanmoins mal connue. Un haplotype de VDR lié à la croissance staturale… L’équipe de F. Jehan (2) s’est intéressée au promoteur du gène VDR qui régule son activité et a découvert des variants polymorphiques de ce promoteur, notamment l’haplotype Hap1 localisé au locus 1012 en amont du gène. Cet haplotype est présent chez 45 % des sujets des populations caucasiennes, alors qu’il n’est retrouvé que chez moins de 1 % dans les populations subsahariennes ou asiatiques. Inversement, l’haplotype Hap2 est rare chez les Caucasiens et fréquent dans les autres populations. L’effet de Hap1 sur la croissance staturale et la densité osseuse, dont la présence modifie l’expression de VDR, a été étudié en utilisant les données de la cohorte ISOS qui réunit des jeunes filles de la région de Caen, chez lesquelles ont été mesurés divers paramètres de croissance, du métabolisme phosphocalcique et de nutrition, tous les 2 ans pendant 4 ans. Au sein de cette cohorte, 47 % des jeunes filles étaient porteuses de l’haplotype Hap1, dont 18,8 % 2 x Hap1 et 48,5 % 1 x Hap1. Les apports calciques étaient relativement importants, évalués à 865 mg/j. Les jeunes filles de cette cohorte ne portant pas Hap1 avaient une croissance staturale plus élevée que celles porteuses de Hap1, significativement différente comparativement à la présence de deux Hap1. Cette différence tend néanmoins à s’atténuer en fin de croissance et n’est pas retrouvée à l’âge adulte. Une comparaison a été réalisée avec les valeurs d’une cohorte moldave, dont les apports calciques sont plus bas (493 mg/j) de même que les apports de produits laitiers (69 mg versus 142 mg/j), alors que les apports en protéines et l’apport énergétiques sont supérieurs. Les taux de 25- OH-D, forme de réserve de la vitamine D, sont similaires entre les deux cohortes ; la calcémie diffère en relation avec la différence des apports. La taille des Moldaves, exprimée en déviation standard par rapport aux valeurs de référence de l’OMS, est moins élevée comparativement aux jeunes filles de Caen (+ 0,69 versus + 0,2). L’effet de la présence de Hap1 sur la taille est comparable dans la cohorte moldave à celui mis en évidence dans la cohorte ISOS. Les effets du polymorphisme de VDR sur la taille semblent donc indépendants des apports calciques. Les effets du polymorphisme de VDR sur la taille semblent indépendants des apports calciques. … et à la densité osseuse Une autre analyse a évalué les effets de Hap1 sur la densité osseuse en fonction de la qualité des apports calciques, selon qu’il s’agit de lait ou de produits laitiers, et montré que seule la quantité de lait absorbée a un impact. La cohorte de Caen a été divisée en tertiles selon la quantité de lait absorbée : 65 ml/j, 65 à 260 ml/j et > 260 ml/j, en testant l’effet de Hap1. En l’absence de cet haplotype, la quantité de lait consommée n’a aucun effet sur la densité osseuse, mais en présence de 1 ou 2 Hap1, la quantité de lait influe significativement sur la densité osseuse, en particulier pour des apports > 260 ml/j. On peut en rapprocher le fait que dans les populations asiatiques ou caucasiennes, où Hap1 est généralement absent, l’apport de lait a un impact très faible sur la densité osseuse. Le lait, différent des produits laitiers ? Ces études montrent que les polymorphismes naturels de la région promotrice du gène de la vitamine D pourraient avoir un impact important sur la croissance, la taille et l’acquisition de la masse osseuse. La présence de l’haplotype Hap1, spécifique des populations caucasiennes, pourrait expliquer en partie les différences de masse osseuse retrouvées entre les différentes populations, selon l’apport de lait. Plus intrigant est le fait que seul le lait, et non les produits laitiers, semble avoir une incidence sur la densité minérale osseuse chez les sujets caucasiens porteurs de l’haplotype Hap1, ce qui suggère que la transformation du lait (par des procédés enzymatiques ou bactériens) en produits laitiers pourrait faire disparaître un facteur non identifié, participant aux effets du calcium sur le métabolisme phosphocalcique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :






