Publié le 18 nov 2007Lecture 14 min
Le vaccin anti-papillomavirus : à partir de quel âge ?
C.Weil-Olivier, Hôpital Louis Mourier, Colombes.
Les autorités sanitaires françaises sont à l’heure actuelle dans la phase de réflexion pour l’établissement des recommandations de la vaccination anti-HPV. L’état actuel des connaissances et quelques perspectives sont rapportés ici.
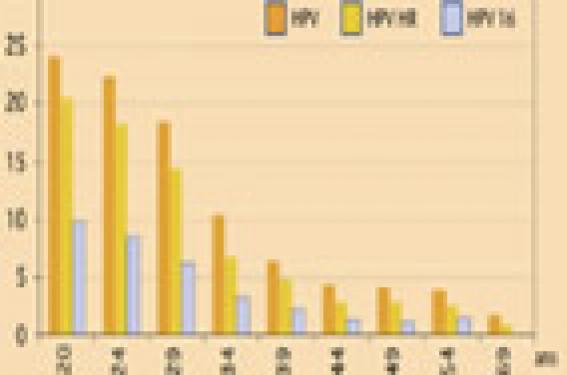
Les pré-requis Les virus oncogènes en cause Les virus papillomavirus humains (HPV), sont des virus à ADN double brin et enveloppés d’une capside. Les protéines non structurales E6 à E7 sont impliquées dans la carcinogenèse du virus. Parmi les protéines structurales de la capside, L1, protéine majeure, induit des anticorps (Ac) neutralisants spécifiques de type. Parmi la centaine de génotypes caractérisés, une quarantaine d’entre eux ont un tropisme marqué pour les muqueuses ano-génitales des deux sexes. Une classification des virus selon le niveau de risque oncogène a été établie grâce à de vastes études épidémiologiques : types à bas risque BR (6 et 11 sont les plus fréquents) et types à haut risque HR (au nombre d’une quinzaine : types 16 et 18, mais aussi 31, 33, 45…). La prévalence des génotypes HR impliqués dans le cancer du col utérin varie selon les continents, les pays (développés ou en voie de développement) et les zones géographiques. L’épidémiologie de l’infection à HPV et de ses conséquences ● Mode de contamination Elle est très fréquente, difficile à éviter, directement sexuelle par contact cutanéomuqueux (de peau à peau, ou de peau à muqueuses : de simples attouchements suffisent), transmissible à partir d’un partenaire infecté. Elle se développe dans les mois qui suivent les premiers contacts. Plus de 60-70 % des femmes (et des hommes) feront une infection à HPV dans leur vie, en priorité dans les premiers mois et années suivant le début de la vie sexuelle. En France, l’âge médian des premiers rapports sexuels est de 17,5 ans (pour les garçons et pour les filles) ; 18 % des filles de 15 ans ont déjà eu des rapports sexuels. La prévalence de l’infection à HPV (figure 1) est maximale chez les femmes jeunes de 16 à 29 ans. Figure 1. Prévalence de l’infection HPV en fonction de l’âge. La prévalence de l’infection à HPV est maximale chez les femmes jeunes de 16 à 29 ans. Les préservatifs assurent une protection partielle contre la transmission des HPV (ce qui ne remet pas en question leur efficacité vis-à-vis d’autres infections sexuellement transmises). ● Infectiosité et immunité Le virus infecte les cellules germinales de la couche basale des épithéliums malpighiens. L’infection est inapparente. Une incubation longue précède l’apparition des premières lésions dans la zone de transformation du col (jonction de l’endocol et de l’exocol). La clairance du virus est lente, en 12-18 mois. (figure 2). La réponse immune de l’hôte, humorale et cellulaire, est tardive, de cinétique lente avec développement d’une réponse locale puis systémique (inconstante) vis-à-vis du génotype infectant. Les Ac neutralisants, produits à un taux faible (par absence de virémie), protègent de la ré-infection par le même type, et disparaissent avec le temps. Leur rôle protecteur après infection naturelle n’est pas établi de manière formelle. La réactivité croisée vis-à-vis d’autres génotypes d’HPV semble limitée. Figure 2. Histoire naturelle de l’infection à HPV. ● Épidémiologie des cancers à HPV L’infection devient persistante dans 10 à 20 % des cas et peut induire des dysplasies cervicales (cervical intra-epithelial neoplasia, CIN) (tableau 1) pouvant alors évoluer (en 10-15 ans) vers un cancer du col (CC) (figure 3). Figure 3. Histoire naturelle du HPV : impact du vaccin et du dépistage. Seules certaines femmes développent des lésions (asymptomatiques). À chacun des stades de bas grade (LSIL) et de haut grade (HSIL), les lésions peuvent disparaître spontanément (tableau 2). certaines femmes sont de ce fait traitées par excès. ● Le test HPV met en évidence l’ADN viral des HPV HR oncogènes. Il est trouvé d’autant plus souvent positif que la lésion cytologique à partir duquel il est pratiqué est de haut grade. Ce test n’est recommandé (et remboursé ; Anaes) qu’en présence de lésions ASC-US (atypical squamous cells of undetermined significance). Les condylomes acuminés Les condylomes acuminés appelés aussi « crêtes de coq », sont liés aux HPV 6 et 11. Leur prévalence est de 3 à 6 % et en augmentation. Leur incidence est 3 à 5 fois supérieure à celle de l’herpès génital. Ils touchent surtout des sujets jeunes (figure 4). Le traitement est pénible et n’évite pas les récidives. Figure 4. Les condylomes acuminés au Royaume-Uni (Angleterre + Pays de Galles). Incidence en 1998 (Données Health Protection Agency -www.hpa.org.uk). Ils reposent sur l’auto-assemblage des protéines L1 en pseudoparticules virales conservant les épitopes cibles des Ac neutralisants et n’ayant pas de caractère infectieux (absence d’ADN). Deux vaccins ont été développés (tableau 3). Le vaccin bivalent Cervarix®, GSK, dirigé contre les HPV 16 et 18, vient d’obtenir une AMM européenne. Le vaccin quadrivalent (Gardasil®, Sanofi Pasteur MSD), dirigé contre les HPV 6, 11, 16 et 18, a reçu l’autorisation de mise sur le marché le 20 septembre 2006. L’évaluation de Gardasil® a porté sur la tolérance, l’immunogénicité et l’efficacité clinique chez plus de 20 000 femmes de 16 à 26 ans,de continents multiples, et sur l’immunogénicité chez les adolescents, garçons et filles âgés de 9 à 15 ans. ● L’analyse de la tolérance n’a pas mis en évidence de signal portant sur un quelconque événement indésirable sévère. Des réactions locales (douleur, érythème) en règle modérées et transitoires ont été notées. La fréquence des réactions systémiques (réactions fébriles, nausées) est similaire à celle du groupe contrôle. Un suivi à long terme sera souhaitable pour écarter tout événement rare pouvant survenir à distance. ● L’immunogénicité a été évaluée en termes d’Ac sériques de type IgG neutralisants. Aucun corrélat de protection n’a pu être défini. – Chez les femmes naïves pour les HPV vaccinaux, les taux d’Ac obtenus après vaccination complète sont élevés. Les Ac, après le pic observé 1 mois après la 3e dose, décroissent pour atteindre un plateau à 24 mois, persistant à 60 mois (recul actuel). Le taux reste supérieur à celui observé au décours de l’infection naturelle, pour chacun des types HPV vaccinaux. – Chez les adolescents, la réponse est augmentée d’un facteur 1,5 par rapport aux femmes de 16 à 26 ans. On manque de données sur l’immunogénicité à long terme, au-delà de 7 mois. – Chez les femmes déjà infectées par les HPV 16 ou 18, les titres d’Ac au 7e mois sont similaires à ceux observés chez les femmes naïves. – La réactogénicité croisée des Ac vaccinaux vis-à-vis d’autres souches d’HPV a été démontrée pour HPV 31 et 45. – Il n’y a pas d’interférence lors de l’administration concomitante du vaccin Hépatite B. Les études avec d’autres vaccins sont en cours. ● L’efficacité clinique de Gardasil® a été évaluée sur la comparaison entre les groupes, vaccinés et contrôle, de l’incidence des lésions de haut grade (CIN2 et CIN3), des adénocarcinomes in situ (AIS) dus aux HPV 16/18 et de toutes les autres lésions génitales. – Chez les femmes naïves pour HPV 16 et 18, âgées de 16 à 26 ans, ayant reçu les 3 doses de vaccin, l’efficacité est proche de 100 % pour l’ensemble des lésions cervicales, de 99 % pour les condylomes vulvaires ou vaginaux et de 100 % pour les lésions vulvaires de haut grade. – Chez des femmes naïves pour les 4 HPV vaccinaux, et n’ayant pas respecté le protocole de vaccination, l’efficacité est de l’ordre de 95 % pour les lésions CIN quel que soit leur grade et de 98 % pour les lésions cervicales de haut grade. – Enfin, dans la population des femmes, très proche de la population générale, ayant reçu au moins 1 dose de vaccin et quel que soit leur statut HPV initial (ayant ou non rencontré l’un des 4 types HPV vaccinaux), l’efficacité est de 39 % pour les lésions CIN2/3 ou AIS, 43 % pour toute lésion CIN et 68 % pour les condylomes. Le vaccin bivalent GSK a fait la preuve, outre de son immunogénicité dans les populations de femmes âgées de 16 à 26 ans et chez les adolescents, garçons et filles de 9 à 15 ans, d’une efficacité clinique contre l’infection persistante et les lésions de type CIN1. Des données complémentaires sont en attente. Ces vaccins n’ont pas d’effet thérapeutique. D’autres études d’efficacité concernant les deux vaccins sont en cours pour les femmes au-delà de 25 ans et chez les hommes homosexuels. Aucune donnée n’est disponible chez les hommes bien portants et les sujets immunodéprimés. En pratique, ces vaccins prophylactiques assurent une prévention primaire, protégeant avec une couverture vaccinale de 100 % d’environ 70 % des cancers du col (ceux liés aux HPV 16 et 18). Ils ne protègent pas contre les infections dues aux autres HPV oncogènes (réactivité croisée démontrée vis-à-vis des types 31 et 45). Leur efficacité semble remarquable contre les lésions cervicales de haut grade liées aux HPV 16 et 18 chez des femmes naïves. Quelle intégration possible dans le calendrier vaccinal ? L’objectif retenu est la prévention individuelle des femmes vaccinées vis-à-vis des sérotypes contenus dans les vaccins. Ni la modification de la transmission d’HPV ni la vaccination des hommes ne sont envisagées à ce jour. – L’âge idéal de primo-vaccination se situe juste avant le début des relations sexuelles. Il y a lieu de penser que les adolescentes, naïves pour les sérotypes vaccinaux, seraient alors protégées de l’infection et de ses conséquences, grâce à la qualité de la réponse immune. L’âge idéal de primo-vaccination se situe juste avant le début des relations sexuelles. – La vaccination des 11-13 ans répond à une proximité du risque (possibles contacts sexuels du fait de flirts) et à un rendez-vous vaccinal (si les co administrations sont possibles). La survenue des premières règles rend propice l’abord de règles d’hygiène, de la contraception et d’une éducation sexuelle. Néanmoins, la durée réelle de protection assurée par les vaccins HPV n’étant pas encore définie, l’éventualité d’un ou de plusieurs rappels nécessaires pour couvrir la période de risque n’est pas écartée. La durée réelle de protection assurée par les vaccins HPV n’est pas encore définie. – La vaccination des 15-17/18 ans, autre rendez-vous vaccinal, est très (trop ?) proche de la zone de risque HPV. La sensibilisation des jeunes filles aux messages touchant à la sexualité et aux affections gynécologiques est pertinente. La vaccination assurerait une protection durable dans les années de fort risque. Néanmoins, bon nombre des adolescentes ont déjà pu être infectées, rendant plus aléatoire l’efficacité vaccinale. Enfin, à l’adolescence, la perception de la santé, des risques éventuels et de la dimension du temps et du futur diffèrent de celle des adultes. Cette population est difficile à capter moins dans l’instant que dans la durée (il faut trois injections de vaccin HPV soit 6 mois minimum de suivi). – Quel que soit l’âge préconisé, l’utilité d’un rappel est pour l’instant impossible à évaluer, mais probable, dans un délai non précisé. – Pour éviter les pertes de chance occasionnées par un ciblage étroit des populations féminines, un programme de rattrapage simultané et transitoire de cohortes de jeunes filles pourrait être proposé jusqu’à 18, voire 26 ans. Les inconvénients en sont la diversité des populations — différentes dans leur maturité, leurs risques, leur approche de la sexualité, avec le risque de messages brouillés —, le plus grand nombre de professionnels de santé concernés et le coût plus élevé du programme. – Enfin, alors que les programmes de vaccination ont été d’abord dans les mains des pédiatres puis des médecins généralistes, le domaine du HPV (pathologie, prévention par dépistage) concerne surtout les gynécologues qui, à ce jour, ne sont pas vaccinateurs. Un message essentiel dans cette population d’adolescentes vaccinées sera de maintenir le dépistage par frottis dans les conditions fixées par les autorités sanitaires. Une réflexion portant sur les avantages respectifs de chacune des stratégies et surtout de leur impact combiné est indispensable. Les vaccins prophylactiques HPV seront-ils facilement acceptés ? Ce point clé repose sur une démarche de formation de tous les professionnels de santé concernés et d’éducation, d’information/ communication auprès du public. Elle doit aborder de façon large l’infection à HPV (prise de conscience, levée des méconnaissances), facilitant une connaissance objective de ses conséquences et des moyens de prévention mis à disposition : le dépistage, prévention secondaire « d’aval », le vaccin prophylactique, prévention primaire « d’amont », avec leurs avantages respectifs, leurs limites et leur bénéfice combiné. Un abord plus large encore des infections sexuellement transmises, une aide à la réflexion sur la sexualité chez les adolescents sont des opportunités à ne pas manquer dans ce contexte. Une consultation offerte (gratuite) aux adolescents traitant de ces questions serait une mesure de santé publique utile. L’évaluation précise de la volonté des parents (à protéger leurs enfants), des adolescentes et jeunes femmes (à recevoir la vaccination) et bien sûr des professionnels de santé (à proposer la vaccination, et motiver les familles) vis-à-vis des vaccins HPV est nécessaire. Le repérage des difficultés, multiples, d’ordre structurel et pragmatique, mais aussi liées à la population cible retenue, est utile. Le public, averti du cancer du col utérin, l’est très peu du HPV, de sa place dans les IST, de son histoire naturelle et de ses liens avec les lésions cervicales. Les parents ont un intérêt certain pour cette vaccination selon plusieurs études anglo-saxonnes ; une information éducative, brève, médicalisée, facilite leur acceptation. Ils font confiance à leur médecin et à ses propositions, atout fondamental dans une politique vaccinale. Elle prendra en compte les dimensions sociétale, culturelle ou religieuse, voire éthique, propres à chaque groupe ethnique ou social. Les médias sont indispensables pour véhiculer des messages informatifs, simples, par la presse écrite, la presse parlée, l’internet. Une communication simple, largeet adaptée faciliterait l’accès aux soins, au dépistage et à la vaccination d’une catégorie de femmes qui, pour l’instant, y échappent. Un engagement clair des autorités de santé dans le domaine du HPV est indispensable, à l’aide d’actions d’éducation, d’information, de formation et de communication. Conclusion Les infections à HPV constituent un enjeu de santé publique mondial et national. L’incidence élevée du cancer du col a conduit historiquement au dépistage par frottis, prévention secondaire qui restera indispensable. Le lien irréfutable entre les types oncogènes 16 et 18, ainsi que quelques autres, conduit maintenant à la mise à disposition de vaccins prophylactiques permettant une prévention primaire des conséquences de l’infection à HPV : les lésions précancéreuses et le cancer du col. Le bénéfice d’un programme de vaccination HPV ne sera visible que dans 15-20 ans, délai nécessaire pour que les lésions de haut grade et cancéreuses ne soient plus diagnostiquées de façon significative. Il s’agit de beaucoup plus qu’une « simple » intégration d’une nouvelle vaccination dans le calendrier vaccinal français. Il importe de bâtir un programme national global, cohérent, prenant en compte les données scientifiques, économiques, culturelles, religieuses et sociétales. Un compromis pertinent doit être trouvé entre les deux mesures complémentaires de prévention : secondaire, le dépistage et primaire, le vaccin. Une vision globale du HPV doit être discutée à l’échelle nationale dans un programme de santé publique anti-HPV.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :