Publié le 31 aoû 2006Lecture 12 min
Le généticien et les maladies rares
P. LABRUNE - Hôpital Antoine-Béclère, Clamart

Le généticien est souvent amené à participer à la prise en charge d’un enfant atteint d’une maladie rare et de sa famille. Sa contribution peut être diverse. Il aide à établir le diagnostic clinique, biologique et le pronostic. Il participe à l’information familiale et organise le diagnostic prénatal.
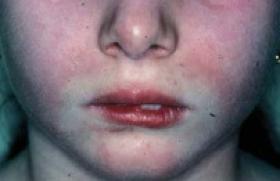
La place du généticien dans la prise en charge des maladies rares est importante ; il peut intervenir à différentes étapes : diagnostics clinique et biologique, information de la famille et sur le pronostic, compréhension d’un mécanisme inhabituel de transmission d’une maladie, distinction entre les facteurs génétiques et non génétiques, réalisation du diagnostic prénatal et de projets de recherche. Aide au diagnostic clinique et biologique La prise en charge d’un nouveau-né ayant une ou plusieurs malformations impose certains examens systématiques. Figure 1. Trisomie 21. a : caryotype standard. b : FISH trisomie 21. • Première étape, l’examen clinique détaillé recherche tout particulièrement des éléments dysmorphiques, qu’il faut noter et photographier, des anomalies des mains, des anomalies des pieds. Les examens complémentaires sont ensuite demandés, en fonction de l’orientation clinique. • Très souvent, un examen caryotypique est nécessaire afin de rechercher une anomalie fréquente, un microremaniement ou, tout au contraire, de s’assurer de la normalité de la formule chromosomique. Il faut savoir rester systématique dans la demande de cet examen cytogénétique. Ainsi on peut, de temps en temps, faire le diagnostic d’une maladie relativement fréquente, la trisomie 21, devant des signes d’appel moins classiques. Citons le cas d’un enfant nouveau-né peu dysmorphique, avec seulement des pieds fendus, hospitalisé pour malaise lors de la première prise du biberon. Le caryotype demandé à titre systématique a alors mis en évidence chez cet enfant, premier-né d’une maman sans antécédent, une trisomie 21 libre et homogène (figure 1). « Au moindre doute, face à une dysmorphie, même discrète, le caryotype doit être demandé. » • Par sa connaissance spécifique, le généticien clinicien peut aider au diagnostic clinique et guider la réalisation des examens complémentaires. Ainsi, la constatation chez un enfant de 18 mois d’un retard des acquisitions, d’un comportement jovial, d’un souffle cardiaque systolique maximum au foyer aortique fait évoquer un syndrome de Williams et Beuren, ce d’autant que la dysmorphie faciale est évocatrice « Le caryotype permet de porter un diagnostic. » Ce diagnostic est confirmé par un examen biologique : la mise en évidence, par hybridation in situ avec une sonde froide (FISH), d’une microdélétion au locus de l’élastine sur le bras long du chromosome 7. Figure 2. Les mutations de l’X fragile. a : représentation en cytogénétique (flèches indiquant le site fragile). b : représentation schématique du gène FMR1. N : normal (6 à 50 répétitions CGG). P : prémutation (50 à 200 répétitions CGG) ; M : mutation complète s’accompagnant de signes cliniques (plus de 200 répétitions CGG). Du diagnostic à l’information de la famille Étude moléculaire : cas du syndrome de l’X fragile • Chez un garçon ayant un retard de langage, et des acquisitions, des stéréotypies, une dysmorphie faciale avec un grand front et des oreilles de grande taille, décollées, le diagnostic de syndrome de l’X fragile est souvent évoqué. La confirmation biologique est alors demandée à l’examen moléculaire. • Chez une fille ayant un retard mental, des troubles du comportement, le diagnostic est plus difficile à évoquer et à porter. En effet, le syndrome de l’X fragile, dont le gène, FMR1, a été cloné il y a près de 15 ans, peut se manifester chez les filles porteuses d’une mutation complète au sein de ce gène. Il est encore plus difficile de prédire le phénotype neurologique chez une fille porteuse d’une mutation complète, puisque environ la moitié d’entre elles sont normales et que pour l’autre moitié, elles sont atteintes d’un retard mental de gravité variable, en général moins sévère que celui rencontré chez le garçon. « L’étude moléculaire du gène FMR1 est indiquée pour le diagnostic de syndrome de l’X fragile. » • Dans ces différents cas de figure, l’étude moléculaire du gène FMR1 permet de porter le diagnostic, de dépister les femmes conductrices et de repérer les hommes normaux transmetteurs. Le syndrome de l’X fragile est lié à la présence, dans une partie 5’ non traduite du gène, d’une amplification nucléotidique liée à l’augmentation du nombre de répétitions d’un triplet CGG (figure 2). L’étude moléculaire du gène FMR1 permet : – de différencier les individus porteurs d’une mutation complète (plus de 200 répétitions CGG) qui ont des manifestations neurologiques constantes chez le garçon, présentes dans 50 % des cas chez la fille ; – de repérer les individus porteurs d’une prémutation (entre 50 et 200 répétitions) qui reste stable au travers d’une méiose masculine, alors qu’elle peut évoluer vers une mutation complète au travers d’une méiose féminine. Examen du caryotype chez l’enfant et les parents C’est également le rôle du généticien clinicien de demander l’examen caryotypique chez un nouveau-né dysmorphique, porteur d’un ensemble malformatif. Les résultats peuvent conduire à la mise en évidence d’anomalies chromosomiques déséquilibrées (microdélétions, trisomies partielles). Dans ces circonstances, le généticien clinicien doit demander l’étude du caryotype des parents afin de rechercher une translocation équilibrée ou une inversion péricentrique chez un des parents, pouvant être à l’origine d’une anomalie déséquilibrée chez l’enfant. Comprendre un mécanisme inhabituel de transmission d’une maladie rare Une fois la maladie rare diagnostiquée, la première étape de toute consultation de génétique est l’établissement de l’arbre généalogique et, dans un second temps – surtout s’il s’agit d’une maladie dont le mode de transmission est habituel –, l’étude moléculaire peut venir en complément, afin de permettre, le cas échéant, un diagnostic prénatal lors d’une grossesse suivante. Par ailleurs, ces études moléculaires peuvent, de temps en temps, mettre en évidence des mécanismes moins fréquents de survenue d’une maladie génétique. C’est ainsi le cas, par exemple, de la survenue d’une disomie uniparentale qui peut être en cause dans le cas de maladies exceptionnelles. Donnons l’exemple d’un enfant chez lequel le diagnostic de maladie de Crigler et Najjar de type I a été porté (hyperbilirubinémie néonatale non conjuguée sévère nécessitant la poursuite d’une photothérapie à l’hôpital puis à la maison). L’étude moléculaire du gène dont les mutations sont à l’origine de la maladie de Crigler et Najjar de type I (UGT1A1) a montré que l’enfant était homozygote pour une délétion du codon 170. L’étude de ses parents, réalisée dans l’hypothèse d’une deuxième grossesse et d’une demande de diagnostic prénatal, a montré que seul son père était hétérozygote pour cette mutation, alors que sa mère n’était porteuse d’aucune anomalie au sein de la séquence codante du gène UGT1A1. Après avoir éliminé une erreur (tube, étiquetage), de nouvelles études moléculaires ont mis en évidence que l’enfant avait reçu en double copie la mutation de son père et que cela était dû à la transmission paternelle d’une double copie d’un chromosome 2 (le gène UGT1A1 est localisé en 2q37). Cet enfant était donc porteur d’une isodisomie paternelle du chromosome 2, à l’origine de la maladie de Crigler et Najjar. Cette constatation était importante puisqu’elle a permis de rassurer pour une grossesse suivante. Figure 3. Embryofœtopathie du nouveau-né de mère éthylique : grand philtrum avec effacement des piliers et lèvre supérieure fine en accent circonflexe. Reconnaître ce qui n’est pas génétique S’il est important de rechercher une cause génétique à une dysmorphie, un retard mental, un syndrome polymalformatif, il faut également se souvenir que l’environnement embryofœtal est important et peut être à l’origine de malformations. Certains médicaments ont été mis en cause : – les antivitamine K sont potentiellement à l’origine de chondrodysplasie ponctuée ; – les inhibiteurs de l’enzyme de conversion sont à l’origine d’anomalies rénales et d’anomalies de fermeture de la voûte crânienne ; – le valproate de sodium et des toxiques comme l’alcool peuvent être à l’origine d’une embryo-fœtopathie chez le nouveau-né d’une mère éthylique. Le nouveau-né puis le nourrisson ont une dysmorphie faciale caractéristique avec un philtrum de grande taille, un effacement des piliers du philtrum, une lèvre supérieure fine en accent circonflexe (figure 3). D’autres exemples peuvent également se rencontrer lors d’infections virales ou parasitaires de survenue anténatale. Aide à l’information sur le pronostic Après le diagnostic d’un syndrome microdélétionnel (syndrome de Williams et Beuren ou microdélétion 22q11), d’un syndrome de Prader-Willi ou d’un syndrome d’Angelman, le généticien doit pouvoir donner une information plus précise du devenir à long terme, des possibilités de prise en charge de l’enfant et du risque de récidive lors d’une éventuelle future grossesse. Souvent, il s’agit d’enfants ou de fœtus chez lesquels une dysgonosomie a été mise en évidence et il faut alors prendre le temps de donner l’information la plus complète possible, ce d’autant que nombre de parents ont accès aux sites internet et arrivent en étant déjà informés. Il est également important de connaître les risques encourus au décours de diagnostics d’affections plus rares telles que le syndrome de Wiedemann et Beckwith : en effet, selon l’anomalie mise en évidence, le risque tumoral est plus ou moins élevé chez les enfants et la surveillance clinique et échographique qui en découle dépend des résultats des examens de laboratoire. Aide au diagnostic prénatal Chaque demande de diagnostic prénatal doit être discutée au cas par cas. Le préalable indispensable est qu’un diagnostic de certitude ait été porté chez le premier cas de maladie rare repéré au sein d’une fratrie. Ainsi, la démarche du généticien sera différente selon que la maladie génétique est diagnostiquée au départ ou non. La maladie génétique n’est pas connue au départ La pathologie est découverte à l’occasion d’une échographihe anténatale. Par exemple, la constatation à l’échographie anténatale de rhabdomyomes cardiaques fœtaux fait évoquer le diagnostic de maladie de Bourneville. Se pose alors la question concernant l’issue de la grossesse. Dans cette situation, il faut envisager, quasi simultanément : – la poursuite des explorations fœtales afin de rechercher une atteinte cérébrale (IRM) ; – la rencontre avec un cardiologue pédiatre ; – l’enquête familiale, voire la mise en place des examens parentaux. Lorsque le diagnostic de maladie de Bourneville est établi avec une quasi-certitude, la décision concernant l’issue de la grossesse doit être prise après consultation et discussion approfondie entre le généticien et le couple. La maladie génétique est connue Dans d’autres situations, il s’agit d’organiser un diagnostic prénatal d’une maladie génétique connue. Un conseil génétique doit être préalablement fourni pour connaître le mode de transmission de la maladie et le risque de récidive d’une éventuelle future grossesse. Les limites liées aux problèmes techniques possibles doivent être expliquées aux parents. De même, il faut expliquer les risques inhérents aux prélèvements nécessaires au diagnostic prénatal. Il faut enfin expliquer que le résultat de ce diagnostic prénatal sera rendu au couple par le médecin prescripteur. Les consentements écrits des parents doivent être recueillis. Aide à la réalisation de projets de recherche L’examen clinique détaillé, la prise de photographies, la réalisation de radiographies de squelettes sont, nous le répétons, des étapes importantes. Il est également indispensable de penser à la conservation de prélèvements biologiques (lignées cellulaires sanguines, ADN total, fibroblastes, etc.). C’est en effet à partir de ces prélèvements conservés que l’on pourra continuer de localiser les gènes de certains syndromes actuellement encore inconnus. C’est également à partir de ces prélèvements conservés que pourra être organisé, à mesure des progrès concernant les localisations génétiques, un diagnostic prénatal. Conclusion Les rôles du généticien dans la prise en charge des maladies rares sont multiples. Il faut insister sur l’importance de l’examen clinique, fondement de la prise en charge de tous ces enfants. Les examens complémentaires ne sont demandés qu’en fonction des orientations cliniques. Les informations familiales doivent également être transmises avec l’aide du généticien.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :