Publié le 03 nov 2022Lecture 9 min
Un asthme « diffi-cile »...
Maylis PENET*, David DRUMMOND**, Grégoire BENOIST* *CHU Ambroise Paré (AP-HP), Boulogne-Billancourt **Hôpital Necker-Enfants malades (AP-HP), Paris
La rubrique « En direct des staffs » est ouverte à tout médecin d’un service de pédiatrie souhaitant partager avec les lecteurs de Pédiatrie Pratique les cas discutés dans son service et qu’il estime suffisamment intéressants et édifiants pour être portés à la connaissance de ses confrères.
Observation
Une jeune fille de 11 ans est adressée en consultation de pneumo-allergologie pédiatrique pour un « asthme ne répondant pas à un traitement de fond bien conduit ».
L’analyse anamnestique des symptômes respiratoires permet d’identifier une toux chronique grasse quasi-quotidienne, sans intervalle libre, avec finalement peu d’épisodes typiques de dyspnée sifflante, ayant de plus une réponse très partielle au salbutamol comme au traitement de fond institué depuis plusieurs années. Ce dernier comporte une association fluticasone–salmétérol en aérosol-doseur à fortes doses, ainsi que du montélukast en comprimé. Un cliché thoracique réalisé trois ans plus tôt a été interprété normal. Ses derniers résultats d’explorations fonctionnelles respiratoires (EFR) sont les suivants : VEMS/CV 84 %, VEMS 1,16 l/s (77 % théorique) sans réversibilité après administration de salbutamol. Elle bénéficie d’un suivi ORL depuis ses premières années de vie, en raison d’une rhinite chronique et d’otites séromuqueuses persistantes pour lesquelles elle a des aérateurs transtympaniques, compliqués d’épisodes récurrents d’otorrhée. Le bilan allergologique n’a pas mis en évidence de sensibilisation pour les pneumallergènes suivants : acariens, Alternaria, chat, chien, bétulacées, graminées.
Le recueil des données du carnet de santé informe sur la découverte anténatale d’une hétérotaxie abdominale, à l’instar de sa sœur aînée, qui partage par ailleurs la même symptomatologie ORL. La patiente est née à 40 SA sans détresse respiratoire néonatale. La croissance staturo-pondérale a été régulière sur la moyenne. Elle ne présente pas de trouble digestif chronique. Les vaccins sont à jour dont le BCG. Les parents sont tous les deux atopiques avec une rhinite pollinique. Le père est fumeur. La famille vit dans un logement salubre, sans animal domestique.
À l’examen clinique, les constantes respiratoires sont : FR 20/min, SpO2 99 % en air ambiant. Il existe une rhinite obstructive manifeste avec un écoulement bilatéral purulent. La toux est effectivement très productive. L’auscultation pulmonaire retrouve des ronchis bilatéraux sans sibilants. Il n’y a pas de déformation thoracique, pas d’hippocratisme digital, pas d’organo-mégalie.
Le tableau respiratoire de cette fille est très évocateur de bronchopathie chronique. Son association à des manifestations oto-rhino-sinusiennes chroniques ainsi qu’à une hétérotaxie, avec de plus des antécédents familiaux similaires oriente fortement vers le diagnostic de dyskinésie ciliaire primitive. Un déficit immunitaire ou la mucoviscidose, autres causes classiques de bronchopathies chroniques, ont été rapidement écartés après réalisation d’un bilan immunitaire et d’un test de la sueur.
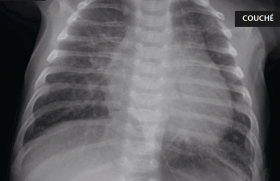
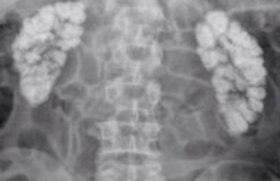
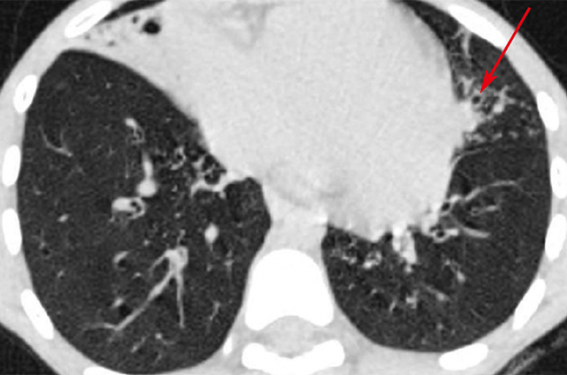
Le scanner thoracique a mis en évidence des épaississements bronchiques majeurs prédominant aux bases, une atélectasie du lobe moyen, ainsi que des dilatations bronchiques et des impactions mucoïdes (figure) ; l’hétérotaxie de type situs ambigus (ou situs inversus incomplet : un nombre limité d’organes sont inversés/un organe normalement latéralisé devient médian) a été également retrouvée. L’ECBC est positif à Haemophilus influenzae 107 UFC/ml et pneumocoque 107 UFC/ml. Le NO nasal est effondré. La fibroscopie bronchique a retrouvé une inflammation diffuse de l’arbre bronchique avec des sécrétions purulentes épaisses notamment au niveau du lobe moyen et de la lingula. Le liquide broncho-alvéolaire (LBA) est inflammatoire avec prédominance de PNN ; la culture a retrouvé Haemophilus influenzae 105 UFC/ml et pneumocoque 105 UFC/ml, déjà identifiés à l’ECBC. L’étude ultrastructurale des cils sur des coupes de biopsie bronchique a identifié que 100 % des cils avaient des anomalies correspondant essentiellement à l’absence de bras de dynéine externes et parfois internes. L’étude génétique est encore en cours. Un TOGD a montré un mésentère commun incomplet.
Figure. TDM sans IV.
A. Coupe thoracique, axiale. Fenêtre parenchymateuse. Atélectasie sous-segmentaire du lobe moyen. DDB (exemple flèche).
B. Coupe abdominale, axiale. Fenêtre médiastinale. Situs inversus avec corps gastrique et rate à droite, foie à gauche étalé.
La prise en charge initiale a consisté en des séances de kinésithérapie respiratoire pour drainage bronchique 3 fois par semaine, une antibiothérapie orale avec l’association amoxicilline et acide clavulanique suivie d’une antibiothérapie alternée pour 3 mois du fait de l’importance des lésions scanographiques et des quantités importantes de pus retrouvées à la fibroscopie, ainsi qu’un traitement par azithromycine 3 fois par semaine à visée anti-inflammatoire. Elle a reçu la vaccination contre la grippe saisonnière, le pneumocoque, ainsi que contre le SARS-Cov2. L’enfant et ses parents ont été informés du diagnostic de dyskinésie ciliaire primitive. Sa sœur a eu le même bilan diagnostique, confirmant également son atteinte. La famille a été informée du risque de volvulus du grêle du fait du mésentère commun incomplet, des signes devant alerter (vomissements verts, douleurs abdominales fortes), et orientée vers un chirurgien viscéral pour avis.
Discussion autour du cas présenté
• Toux chronique : une démarche rigoureuse
La première étape diagnostique en cas de toux chronique consiste en une anamnèse et un examen clinique rigoureux avec recherche de signes de toux spécifique et de signes d’alerte (antécédent de syndrome de pénétration, fausses routes, malaises avec cyanose, dyspnée aux 2 temps, wheezing ou stridor persistant, encombrement bronchique permanent, limitation des activités, retentissement sur le sommeil, retard de croissance, infections répétées et/ou sévères, souffle cardiaque, déformation thoracique, hippocratisme digital, etc.), ainsi que la réalisation d’un cliché de thorax de face en inspiration. En l’absence d’orientation évidente et/ou de signes d’alerte, le bilan de 1re intention comporte des EFR, un bilan allergologique et un avis ORL.
Dans l’observation présentée, l’encombrement bronchique permanent avec toux grasse productive et anomalies auscultatoires ont constitué des signes d’alerte requérant un avis spécialisé et un bilan comprenant notamment un scanner thoracique, ainsi qu’une enquête immunitaire et un test de la sueur. Les diagnostics à évoquer devant un tableau de bronchopathie obstructive diffuse tel qu’observé au scanner de cette patiente sont avant tout un déficit immunitaire humoral, une dyskinésie ciliaire primitive, une mucoviscidose ou une séquelle d’infection virale (bronchiolite oblitérante).
Un asthme difficile à contrôler doit non seulement conduire à vérifier l’observance thérapeutique et les techniques d’inhalation, mais également à écarter un autre diagnostic. Le caractère gras de la toux, le peu d’épisodes spastiques, la mauvaise réponse thérapeutique et l’absence de réversibilité aux EFR sont autant d’indices de suspicion pour un diagnostic différentiel de l’asthme. Enfin, le caractère purulent de la rhinite chronique n’est pas évocateur d’une origine allergique, en accord avec l’absence de circonstances d’exposition évocatrices et de sensibilisation identifiée.
• Dyskinésie ciliaire primitive : l’essentiel
La dyskinésie ciliaire primitive (DCP) est une maladie respiratoire rare d’origine génétique, de trans- mission principalement autosomique récessive. Sa prévalence en population générale est estimée à environ 1/16 000, avec probablement un sous-diagnostic.
Les manifestations cliniques sont reliées à des anomalies ultrastructurales et/ou fonctionnelles des cils mobiles présents principalement à la surface de l’épithélium des voies aériennes, du nez aux bronchioles, provoquant un défaut d’épuration du mucus.
Les manifestations ORL sont sou- vent au premier plan les premières années avec : rhinite chronique purulente, otite séromuqueuse chronique et survenue d’otorrhée sur aérateurs transtympaniques (100 % cas), sinusite chronique purulente diffuse avec évolution possible vers une polypose nasosinusienne. Une attention doit être portée aux éventuelles difficultés d’audition et de langage.
Les manifestations respiratoires sont également précoces avec : détresse respiratoire néonatale (50 % cas) ; toux chronique productive (100 % cas), infections broncho-pulmonaires récidivantes avec évolution fréquente vers une dilatation des bronches. La FR et la SpO2 doivent être mesurées.
D’autres manifestations sont possibles, en lien avec l’atteinte d’autres organes possédant des dérivés ciliaires : polykystose rénale, rétinite pigmentaire, cardiopathie complexe, troubles de fertilité.
Une anomalie de latéralisation des viscères est fréquente (50 % cas) et s’intègre dans le syndrome de Kartagener en cas de triade : sinusite chronique, dilatation des bronches, situs inversus.
Le diagnostic de DCP est fait vers un âge moyen de 5 ans, parfois plus tardivement. L’enquête diagnostique est avant tout générale, afin d’argumenter les causes de bronchopathies.
Le cliché thoracique peut retrouver un syndrome bronchique diffus, des troubles de ventilation, parfois un situs inversus comme évoqué. Le scanner thoracique sera plus probant, avec comme principales anomalies selon l’âge et la sévérité : un épaississement des parois bronchiques, des dilatations des bronches, des impactions mucoïdes, des micronodulations bronchiolaires, des zones de condensation alvéolaire ; ces lésions pulmonaires sont surtout déclives, prédominant aux lobes inférieurs, au lobe moyen et à la lingula.
Les EFR, si pratiquées dans le cadre d’une toux chronique, retrouvent une CV et un VEMS souvent abaissés chez l’enfant, avec un rapport VEMS/CV qui devient anormal plus tardivement.
Un test de la sueur permet d’éliminer une mucoviscidose, autre cause classique de bronchopathie chronique ; un bilan biologique écarte aisément un déficit immunitaire héréditaire. Un ECBC recherche une colonisation bactérienne, le plus souvent à H. influenzae, S. pneumoniae ou P. aeroginosa.
Des examens plus ciblés pour le diagnostic de DCP sont à réaliser en milieu spécialisé. La mesure du NO nasal est un test non invasif de dépistage utile ; son taux est très souvent effondré chez les sujets atteints par rapport à celui des sujets sains. L’étude du mouvement ciliaire en microscopie optique sur brossage nasal ou bronchique peut également orienter. Le diagnostic sera confirmé par l’analyse de l’ultrastructure ciliaire en microscopie électronique sur biopsie épithéliale nasale ou bronchique. Une étude génétique sur prélèvement sanguin sera réalisée ensuite. Un conseil génétique sera utile.
Si la porte d’entrée diagnostique était « respiratoire », le bilan d’extension comportera une évaluation ORL avec examen otologique, endoscopie nasale, étude de l’audition et bilan du langage ; une échographie abdomino-rénale, une échographie cardiaque, un fond d’œil (dès 10 ans).
La prise en charge thérapeutique repose sur un suivi en centre spécialisé de maladies respiratoires rares tous les 3 à 6 mois, des irrigations nasales et un traitement des atteintes otologiques, le drainage bronchique par kinésithérapie régulière, une antibiothérapie lors des exacerbations bronchiques ou ORL ou si mise en évidence de colonisations. Les corticoïdes inhalés n’ont pas de bénéfice en l’absence d’asthme associé ; l’azithromycine administrée au long cours à visée anti-inflammatoire a un impact sur la prévention des exacerbations.
Il convient de mettre à jour le calendrier vaccinal (notamment contre le pneumocoque, la grippe saisonnière et la coqueluche), veiller au maintien d’une activité physique régulière et adaptée, éviter le tabagisme (passif comme actif) et faire attention à la prise en charge nutritionnelle.
Grâce à l’ensemble de ces mesures, le déclin de la fonction respiratoire au cours de la vie reste limité (de l’ordre de 0,5 % par an sur le VEMS), et l’espérance de vie est considérée comme peu diminuée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :