Publié le 28 oct 2009Lecture 8 min
L’asthme aujourd’hui et demain. Un entretien avec le Pr PJ Barnes.
Propos recueillis par G. Gertner
Le Pr Peter J Barnes, expert de l’asthme reconnu internationalement, chef de service de pneumologie (National Heart and Lung Institute, Londres), professeur de pharmacologie clinique, nommé « Médecin de la décennie » par l’Imperial College de Londres, est l’un des auteurs les plus cités dans la littérature médicale. Il est par ailleurs membre du groupe ADMIT (Aerosol Drug Management Improvement Team - www.admit-online.info ) qui a pour objectif d’améliorer la prise en charge des pathologies respiratoires obstructives en Europe, en favorisant une bonne utilisation des dispositifs d’inhalation disponibles et en encourageant la sélection du système d’inhalation le plus adapté à chaque patient.
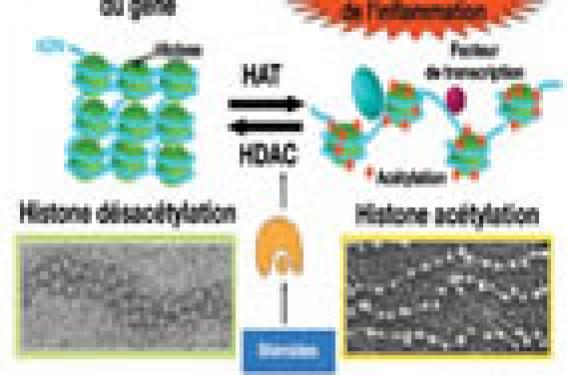
L’asthme est il une maladie génétique ou due à l’environnement, une maladie inflammatoire ou immunologique ? Pr Peter J Barnes : En fait, l’asthme est tout cela à la fois. La prédisposition à l’allergie mais également la sévérité de l’asthme dépendent en partie de mécanismes génétiques. Cependant, le grand nombre de gènes impliqués (plus d’une centaine) dans la maladie font de l’asthme une pathologie génétique complexe. De nombreux chercheurs essaient de déterminer quels sont les gènes les plus importants, afin de savoir de quel type d’asthme est atteint le patient et à quelle sorte de traitement il est susceptible de répondre. Les facteurs environnementaux vont également déterminer quels patients allergiques développeront un asthme. Mais l’asthme est, bien entendu, également une maladie inflammatoire des voies aériennes. On peut même être certain que tout patient symptomatique a une inflammation des bronches. Enfin, il s’agit aussi d’une maladie immunologique, car le mécanisme de l’inflammation est déterminé par des facteurs immunologiques, particulièrement par les lymphocytes T. Y a-t-il un intérêt à définir des phénotypes d’asthme ? PJ Barnes : Il sera sûrement important dans un proche avenir de définir différents phénotypes d’asthme, principalement pour préciser quels patients répondent le mieux à certains traitements. Pour l’instant, cela ne paraît pas nécessaire dans la mesure où 95 % des asthmatiques répondent efficacement aux corticoïdes inhalés et aux bêta-agonistes. Cependant, nous avons besoin de nouveaux traitements plus spécifiques, qui seraient utiles aux 5% des sujets ne répondant pas aux traitements classiques. Mais, le faible effectif de patients concernés pose un problème à l’industrie pharmaceutique, pour qui le développement de telles molécules est très onéreux. Il reste que le problème majeur n’est pas tant le manque de médicaments efficaces que la non-observance des patients ou la mauvaise utilisation des dispositifs médicaux. Pour preuve, une étude européenne a montré que l’asthme était mal contrôlé chez plus de 50 % des patients asthmatiques malgré une prescription adaptée. Aussi, la question essentielle qui reste à régler est davantage de savoir comment obtenir une meilleure observance et une bonne utilisation des produits existants, à la bonne dose, que de trouver de nouveaux médicaments. Les problèmes sont-ils similaires dans la BPCO ? PJ Barnes : Le problème est totalement différent dans la BPCO pour laquelle nous ne disposons pas d’anti-inflammatoires efficaces, comme les corticostéroïdes dans l’asthme. Nos travaux de recherche nous ont permis de comprendre le mécanisme d’action des corticostéroïdes dans l’asthme : ils répriment l’activité des gènes codant pour les protéines de l’inflammation et ce, à des doses relativement faibles. Plus précisément, ils modifient la structure de la chromatine en désacétylant les histones qui entourent l’ADN (histones désacétylases HDAC1 et HDAC2). Les stéroïdes interrompent la transcription des gènes de l’inflammation en réorganisant l’ADN autour des histones. Cela entraîne une condensation de la chromatine, réduisant l’accès des facteurs de transcription à leurs sites de fixation, inhibant ainsi l’expression des gènes concernés. Dans la BPCO, on observe une réduction de l’activité HDAC2, ce qui empêche les corticostéroïdes d’exercer leur activité anti-inflammatoire. Il faut ajouter que le tabagisme est un facteur important de résistance à la corticothérapie inhalée, en altérant le recrutement d’histones désacétylases. Aussi, avons-nous développé de nouvelles approches thérapeutiques des maladies inflammatoires telles que l’asthme résistant, la BPCO, le syndrome de détresse respiratoire aigu, mais aussi la polyarthrite rhumatoïde, la sclérose en plaques, les maladies inflammatoires chroniques intestinales… autant de pathologies qui répondent mal aux corticoïdes. Cela concerne certains anti-inflammatoires à large spectre (inhibiteurs de la calcineurine ou autres immunomodulateurs, inhibiteurs de la phosphodiestérase 4 ou facteur nucléaire kappa B [NFKB]) et ce, bien que toutes ces molécules soient à l’origine d’effets secondaires relativement importants. Comme nous l’avons publié très récemment (Lancet 2009 ; 373 (9678) : 1905- 17), une stratégie thérapeutique alternative consiste à s’opposer à la résistance aux corticoïdes en bloquant les mécanismes sous-jacents : utilisation de la vitamine D pour restaurer l’interleukine 10, activation de l’HDAC2 par la théophylline, entre autres. Comment expliquez-vous la marche allergique qui passe de l’allergie alimentaire à l’asthme en passant par la dermatite atopique ? PJ Barnes : Les bases de l’atopie sont de nature génétique et environ 40 % de la population des pays développés est atopique. Cela signifie qu’il s’agit de personnes susceptibles d’exprimer une rhinite allergique ou asthme. Or, tous ne développent pas ces pathologies. Ce sont donc probablement des facteurs environnementaux qui sont déterminants dans l’expression allergique. On remarque que très souvent la rhinite précède l’asthme et les raisons de ce mécanisme ne sont pas très claires. Dans l’asthme lié à une intolérance à l’aspirine, pathologie de l’adulte qui débute par une rhinite 3 ans avant que n’apparaisse un asthme, il semble que l’inflammation nasale affecte progressivement les voies respiratoires inférieures. Par ailleurs, une fois l’asthme installé, il ne disparaît jamais complètement. De même, l’asthme commence souvent vers l’âge de 3 ans, passe par une période sans symptômes pendant plusieurs années, puis réapparaît à l’âge adulte, souvent à l’occasion d’une infection virale. Il semble que les asthmes intrinsèques qui apparaissent pour la première fois chez certains patients âgés soient également dus à certains virus. À noter cependant que l’inflammation des bronches de ces patients est de même nature que celle que l’on observe chez les personnes ayant un asthme de type allergique. Quels sont les moyens diagnostiques et d’exploration susceptibles de se développer dans l’avenir ? PJ Barnes : Le diagnostic d’asthme est aujourd’hui clinique et les EFR suffisent dans la très grande majorité des cas à faire le diagnostic. La question du diagnostic différentiel avec la BPCO se pose parfois chez des sujets âgés, mais un test thérapeutique avec des corticostéroïdes permet de trancher. Par ailleurs, on a pu envisager de faire des tests génétiques, mais l’asthme sévère et la BPCO ont de nombreux gènes en commun. Sur le plan radiologique, il n’est pas facile d’obtenir de bonnes images des voies aériennes. Le scanner permet de visualiser le parenchyme et, par là même, de faire par exemple le diagnostic d’emphysème. En revanche, l’IRM semble prometteuse car, associée à l’inhalation d’un gaz polarisé (hélium-3 ou xénon-129), elle permet une visualisation des bronches et bronchioles, de la structure pulmonaire au niveau alvéolaire, ainsi que la mesure de la ventilation régionale de chaque lobe et des échanges gazeux dans chaque territoire. Il s’agit là d’une voie de recherche qui pourra avoir des applications cliniques futures, mais elle ne contribuera probablement pas au diagnostic. Quelles sont les perspectives en termes de progrès thérapeutiques ? PJ Barnes : La théophylline à très faibles doses semble efficace à la fois dans l’asthme et dans la BPCO. Aussi, nous essayons de développer de nouveaux médicaments ayant le même mécanisme d’action que la théophylline, mais ne posant pas de problème d’interactions médicamenteuses. En revanche, les nouveaux antiinflammatoires en cours de développement, au mécanisme d’action original, semblent avoir des effets secondaires importants. Quant aux anti-IgE, ils ne concernent qu’un très faible nombre de patients atteints d’asthme sévère. À titre d’exemple, dans notre hôpital, qui est un centre de référence en matière d’asthme sévère, nous n’avons que 4 patients sous anti-IgE et on ne compte que 60 personnes traitées par anti-IgE dans tout le Royaume-Uni. Il faut préciser que les guidelines en la matière sont très restrictives. Les anti-TNF ont semblé un temps une voie intéressante, mais les effets secondaires les font récuser. En revanche, les anti-IL5 pourraient, au vu d’études récentes, réduire le nombre des exacerbations chez certains patients ayant un asthme résistant aux corticoïdes et chez lesquels on trouve des éosinophiles dans l’expectoration. En conclusion, on peut dire que la très grande majorité des asthmatiques peut vivre normalement et avoir une espérance de vie équivalente au reste de la population. L’exemple donné par de nombreux grands sportifs asthmatiques est là pour le démontrer. La condition nécessaire pour obtenir cette qualité de vie est de prendre régulièrement et correctement son traitement, et ce, à l’aide d’un dispositif d’inhalation adapté à chacun.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :