Publié le 06 mar 2023Lecture 16 min
JDP 2022 : focus sur les enfants
Caroline GUIGNOT, Lille - Caroline MARTINEAU, Paris
Les Journées Dermatologiques de Paris (JDP) se sont tenues en 2022, du 29 novembre au 3 décembre. Des déficits immunitaires primitifs à l'eczéma de contact, en passant par les nouveautés en dermo-pédiatrie, la rédaction a sélectionné quelques communications d'intérêt pour l'information et la pratique du pédiatre.
Déficit immunitaire primitif de l’enfant
Quels sont les signes dermatologiques évocateurs ?
• C. Guignot - D’après la communication de L. Polivba, A. Welfringer Morin, P. Bataille, C. Bodemer sur le « Déficit immunitaire primitif et manifestations cutanées en pédiatrie »
Si les infections récurrentes et persistantes constituent un signe d’appel, le démembrement progressif des déficits immunitaires suggère que d’autres manifestations (néoplasiques, auto-immunes, auto-inflammatoires, etc.) peuvent aussi interpeler. Revue de cas incitant à la prudence.
Aujourd’hui, les déficits immunitaires primitifs (DIP) sont bien démembrés et le nombre de maladies monogéniques spécifiques a explosé. Aussi distingue-t-on les déficits immunitaires combinés touchant les lymphocytes T et B, ceux touchant les seules cellules B, ceux impactant la phagocytose, les défauts intrinsèques de l’immunité innée, ainsi que les pathologies auto-inflammatoires, les déficits en complément et les phénocopies des DIP. Les infections ne sont donc pas les seules manifestations révélatrices, elles sont rejointes par les néoplasies, les auto-immunités et les auto-inflammations, les allergies et les hyperplasies lymphoïdes.
D’une manière générale, 50 % des DIP sont associés à une atteinte cutanée, qui est une infection dans un tiers des cas. Des infections sévères, persistantes et récurrentes doivent en ce sens, interpeller. Cependant, une atteinte cutanée moins sévère peut conduire à écarter à tort un tel diagnostic. Aussi, d’une manière générale, un DIP peut être plus largement suspecté en présence d’une infection cutanée récidivante et/ou inhabituelle, associée à une dermatose inflammatoire chronique étendue, résistante ou dépendante aux dermocorticoïdes forts, notamment à la naissance et durant les premiers mois de vie, et/ou lorsqu’il y a des anomalies morphologiques constitutionnelles.D’une manière générale, 50 % des DIP sont associés à une atteinte cutanée, qui est une infection dans un tiers des cas. Des infections sévères, persistantes et récurrentes doivent en ce sens, interpeller. Cependant, une atteinte cutanée moins sévère peut conduire à écarter à tort un tel diagnostic. Aussi, d’une manière générale, un DIP peut être plus largement suspecté en présence d’une infection cutanée récidivante et/ou inhabituelle, associée à une dermatose inflammatoire chronique étendue, résistante ou dépendante aux dermocorticoïdes forts, notamment à la naissance et durant les premiers mois de vie, et/ou lorsqu’il y a des anomalies morphologiques constitutionnelles.
Approche générale
En pratique, clinique, les manifestations cutanées révélatrices peuvent être différentes selon l’âge. Leur association à d’autres manifestations – infection, inflammation/dysimmunité et anomalies du développement – aident à orienter le diagnostic, notamment en cas d’histoire familiale et de signaux au niveau de la courbe staturopondérale. En cas de doute, un bilan suffisant mais non exhaustif permet de screener largement les risques et de se faire une première idée : il doit comporter NFS, plaquettes, dosage des différentes immunoglobulines, sérologies vaccinales, anti-corps antiprotéines et antipolysaccharides. Si les résultats sont anormaux (attention à l’interprétation des taux selon l’âge de l’enfant), le DIP est probable et l’enfant doit être orienté vers un centre expert pour compléter l’exploration. Si les résultats sont normaux mais les lésions persistantes malgré une bonne prise en charge, il est également important de les envoyer vers ces centres. La difficulté est de ne pas investiguer trop loin ni de passer à côté d’un DIP véritable. Aussi, il est important de ne jamais minimiser des infections micro-biologiques différentes associées et inhabituelles (bactériennes, virales) et/ou une infection qui persiste et s’étend, même si les premiers bilans sont normaux. Il peut être nécessaire de reproduire le bilan après quelques mois lorsque le tableau d’un enfant continue à présenter des événements réguliers. Il invite aussi à ne jamais considérer comme trivial un signe clinique cutané chez l’enfant (prurit, saignement, otites à répétition).
Quelques diagnostics différentiels à garder en tête
• Deux causes rares illustrent bien cette difficulté, car associées à un tableau clinique initial peu sévère : le syndrome de WHIM (verrues, hypogammaglobulinémie, infections HPV et bactériennes cutanées) qui correspond à des infections bactériennes récidivantes souvent mineures mais associées et persistantes, ou le syndrome de Wiskott-Aldrich (maladie monogénique récessive liée à l’X) qui combine une micro- thrombocytopénie, un eczéma de type atopique et des infections.
Un purpura, des infections d’étiologies diverses, une urticaire, de l’allergie, un asthme, etc. peuvent compléter le tableau clinique tandis que le bilan biologique peut être normal ou quasi normal initialement, puis évoluer avec le temps. Cette maladie est associée à un risque élevé de lymphome.
• Le syndrome de Job ou de Buckley, lui, se caractérise par une éruption papuleuse, dès les premières semaines avec un fort prurit et une lichénification. La présentation de ce syndrome, lié à un syndrome d’hyper-IgE, peut être différente selon l’âge, avec des anomalies morphologiques plus ou moins marquées (front pro-éminent, piqûres de la peau du visage, anomalies natales, etc.). Par la suite, il conduit à des infections cutanées staphylococciques, des candidoses et des pneumopathies bactériennes ou fongiques récidivantes avec des abcès cutanés « froids » (sans signe inflammatoire ou fièvre, etc.) récurrents à staphylocoques.
• Le DIP peut aussi constituer un diagnostic différentiel face à une érythrodermie, aux côtés des deux autres étiologies, d’une part infectieuse, notamment à staphylocoque avec décollement superficiel de la peau, d’autre part de génodermatose. Une biopsie permet de mettre en évidence un infiltrat inflammatoire typique dans le DIP, dont l’aspect peut être trompeur.
Parmi les syndromes auto-immuns à expression cutanée, peuvent notamment être cités deux syndromes rares : le syndrome IPEX (Immune dysregulation, Polyendocrinopathy, enteropathy, X-linked) chez l’enfant de quelques semaines qui présente des diarrhées, une hyperéosinophilie, un syndrome hyper-IgE, avec exocytose lymphocytaire et nécrose kératinocytaire. Le syndrome APECED (Autoimmune Polyendocrinopathy Candidiasis Ectodermal Dystrophy), de transmission autosomique récessive, doit être évoqué face à une triade de symptômes : candidose cutanéo-muqueuse chronique, hypoparathyroïdie et insuffisance surrénalienne, sachant qu’en cas d’antécédents familiaux, la survenue d’un seul de ces éléments suffit. D’autres événements de type anomalies de l’émail et des ongles, atteinte digestive, pelade ou vitiligo, etc. peuvent leur être associés, l’érythrodermie n’étant pas systématique.
Certains DIP favorisent une prédisposition élective aux candidoses cutanéomuqueuses, notamment ceux associés à une mutation touchante l’IL-17 : tableaux d’infections cutanées fongiques, candidoses cutanéo-muqueuses, dermatophytoses profuses ou mycoses invasives atteinte cutanée.
Des manifestations de type BCGite disséminée peuvent survenir chez des enfants ayant un DIP et ayant été vaccinés par le BCG (virus atténué). Dans 1 à 10 % des cas, la vaccination peut conduire à des réactions loco-régionales au point d’injection (nodule induré, ulcération, adénopathie axillaire ou abcès) qui évoluent favorablement, mais ces manifestations sont plus sévères en cas de DIP et peuvent être révélatrices : un abcès > 1 cm, une lymphadénopathie suppurée et une atteinte systémique (ostéomyélite ou maladie multisystémique) dans les 6 mois après le vaccin peut être rapidement évolutive et fatale en l’absence de traitement.
Enfin, il faut citer l’infection chronique active à l’EBV (CAEBV) : après la primo-infection, le virus qui reste habituellement en latence dans les lymphocytes B, peut également le rester dans les lymphocytes T. La CAEBV peut demeurer localisée au niveau cutané avec, par exemple, des allergies sévères et des réactions cutanées majeures après des piqûres de moustiques, mais il peut aussi devenir systémique ou évoluer vers un lymphome T EBV-induit. Parmi les causes de cet échappement figurent l’immunodéficience cellulaire. La CAEBV, qui touche surtout l’adolescent ou le jeune adulte, est largement sous-diagnostiqué, cette entité est récente et sa présentation clinique est assez polymorphe, avec des réactions inflammatoires atypiques, une hypersensibilité aux piqûres de moustiques, des rashs cutanés, un hydroa vacciniforme (œdème facial), des vascularites, un infiltrat lymphocytaire T inexpliqué, une dermatomyosite. Dès lors, une PCR-EBV doit permettre d’orienter le diagnostic.
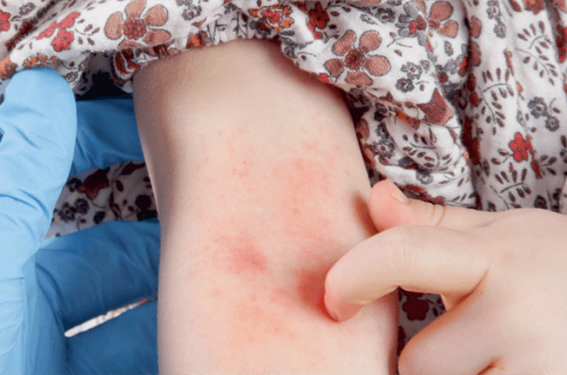
Eczéma de contact : penser aux causes que les parents oublient d’évoquer
• C. Guignot - D’après la communication de N. Bellon, B. Milpied et A. Barbaud, FMC3 « L’eczéma de contact de l’enfant : quand suspecter, quels allergènes, comment tester ? »
Face à la multiplication des allergies liées à des activités en vogue chez les enfants (loisirs, sports, etc.), l’investigation doit être plus que méthodique.
Cliniquement, une éruption palmoplantaire, au niveau péribuccal ou périombilical, située en regard des élastiques des couches ou des vêtements, des atteintes des plis ou du siège chez le nourrisson, etc. invitent à suspecter l’eczéma de contact. De même, les eczémas résistants à un traitement bien conduits, les eczémas nummulaires, les érythrodermies et les eczémas du visage (pouvant être liés à un allergène aéroporté) doivent aussi faire évoquer ce diagnostic.
L’histoire clinique et personnelle de l’enfant doit être approfondie et l’interrogatoire porter sur les produits utilisés pour l’hygiène, les soins du corps, les activités de loisirs, etc. Le rôle des couches, lingettes, produits utilisés sur le siège doit, par exemple, être interrogé chez les plus petits lorsque le siège est touché.
S’il existe une dermatose initiale d’origine inconnue, il faut évaluer avec les parents s’il s’agit d’une aggravation de dermatose pré-existante (stable ou non) : des dermatoses initiales peuvent en effet être compliquées par des manifestations d’eczéma liées aux antiseptiques ou aux corticoïdes avec lesquels elles sont traitées.
Batterie standard et enquête policière
L’exploration diagnostique repose sur l’utilisation de batteries de tests épicutanés standards, dont les allergènes professionnels sont retirés : à défaut ceux-ci pourraient favoriser la sensibilisation. Les batteries adultes peuvent schématiquement commencer à être utilisées à partir de 12 ans. Pour identifier l’haptène, l’enquête, quasi « policière », doit permettre de passer en revue la sémiologie, le contexte des manifestations, sans omettre les contacts indirects aéroportés et les photosensibilisations.
Tous les produits personnels, y compris les produits d’hygiène (soins de la peau et des cheveux, etc.) et les traitements locaux (émollients, dermocorticoïdes) doivent être testés. Face à une chéilite, il faut penser à tester les baumes à lèvres, les dentifrices, les médicaments topiques utilisés localement, etc. Les produits irritants (savons, shampoings, etc.) doivent toujours être testés après dilution pour éviter les réactions d’irritation. Il faut aussi faire attention aux produits d’origine naturelle qui peuvent contenir des allergènes alimentaires favorisant des réactions cutanées, voire anaphylactiques après sensibilisation. Chez l’enfant, les principaux allergènes sont le nickel (repérable par spot test) et le cobalt, certains antibiotiques topiques (néomycine, bacitracine), les parfums, les conservateurs, les surfactants, etc., ainsi que l’aluminium. Des granulomes postvaccinaux liés à l’hydroxyde d’aluminium peuvent être le signe d’une sensibilisation de contact. Plus le vaccin a été réalisé de manière superficielle, plus le risque de sensibilisation est important.
Cependant, une étude suédoise a montré que 75 % des enfants perdent cette sensibilité à 5 ans.
Les eczémas nummulaires, qui sont plus fréquents parmi les populations d’origine non européennes, notamment chez le garçon et à mesure de l’avancée en âge, sont notamment liés aux formaldéhyde, baume du Pérou, benzalkonium, méthylisothiazolinone (présent dans le slime), propylène glycol et fragrance-mix I. Outre les eczémas directs, des lésions peuvent indirectement être causées par des allergènes manuportés (chaîne de cou métallique, gommes au bout des crayons ou élastiques de cheveux devant un eczéma du visage), aéroportés (isothiazolinones des peintures, des produits parfumés, huiles essentielles), voire liés à un contact avec un tiers exposé à un allergène (eczéma par procuration). Attention également aux plantes contenant des furocoumarines qui peuvent engendrer des problèmes de phytophototoxicité (agrumes, panais, figuier, etc.).
Parmi les allergènes contemporains, il faut savoir que des allergies aux métaux (nickel, chrome, cobalt) et des acrylates peuvent apparaître avec la manipulation du matériel informatique, de téléphones portables et certains écouteurs. Le matériel sportif (combinaison de plongée contenant des thiourées, protège-tibia contenant de l’acétophénone azine, etc.) est constitué de mousses ou de colles qui peuvent conduire à des manifestations locales mais aussi à distance. Ces allergènes peuvent aussi être présents dans des chaussures ou des tongs, etc. Dans ces derniers cas, il faut donc tester les différents composants de la chaussure et les produits de traitement à la chaussure.
La saisonnalité des manifestations et leur chronologie par rapport à l’été ou la rentrée scolaire (moments propices aux nouvelles activités) peut aider à orienter l’enquête. L’été, l’hyperhidrose peut aussi favoriser la sensibilisation.
Si tous les résultats des patch-tests sont négatifs, il faut penser à évaluer l’hypothèse d’une dermite de contact aux protéines qui correspond à la phase tardive d’une allergie modérée immédiate : son diagnostic repose sur des prick-tests.
Eczéma de contact au cours de la dermatite atopique
L’altération de la barrière cutanée liée à la dermatite atopique facilite la pénétration des irritants et allergènes. Les tests sont utiles dans ce contexte, leur pertinence étant chez ces enfants supérieure à celle observée chez l’adulte.
La recherche d’une allergie de contact doit vraiment faire partie intégrante de l’exploration d’une dermatite atopique. Elle repose sur les mêmes principes et les mêmes recherches allergéniques que chez l’enfant non atopique. Néanmoins, ils doivent idéalement être menés en dehors des poussées et à distance des traitements (UV, immunosuppresseurs, 2-3 jours après arrêt des corticoïdes locaux, etc.). Les tests peuvent toutefois être conduits chez l’enfant atopique traité par dupilumab.
Dans ce contexte, les enfants ont souvent recours aux traitements locaux, ce qui invite à évoquer systématiquement leur rôle : dermocorticoïdes, émollients, antiseptiques, etc. Pour exemple, la biseptine, qui contient trois composés (chlorhexidine, acide benzylique, benzalkonium) est souvent en cause dans des manifestations cutanées de sensibilisation chez les enfants atopiques qui, peuvent être considérées à tort comme de l’érysipèle.
L’interprétation et la lecture des tests est plus difficile chez l’enfant atopique car il peut être délicat de distinguer les réactions allergiques des réactions d’irritation, notamment liées aux métaux. Il ne faut donc pas poser trop rapidement le diagnostic d’allergie, ni omettre de surveiller les réactions tardives chez ces enfants : il faut recommander aux parents de ne pas effacer les grilles de tests immédiatement, afin de pouvoir qualifier des manifestations qui n’apparaissent parfois qu’après 5 à 7 jours.
Quoi de neuf chez l’enfant en dermatologie ?
• C. Martineau - D’après la communication de O. Boccara (hôpital Necker, Paris)
Savoir dépister à bon escient, ni trop ni trop peu, les complications neurologiques chez les enfants porteurs de RASopathies et/ ou de nævus, connaître les particularités des naevus unguéaux et des mélanomes, comprendre l’intrication de la barrière cutanée, du microbiome et de l’inflammation dans les ichtyoses et les dermatites atopiques de l’enfant ont été les sujets retenus par la dermatologue pédiatrique, Olivia Boccara lors de son intervention.
Complications neurologiques dans les RASopathies : sélectionner les cas à risque
La problématique et la pertinence du dépistage systématique des complications neurologiques dans les RASopathies (mutations somatiques ou constitutionnelles de la voie RAS) chez le nourrisson et le jeune enfant est une question récurrente. Dans la neurofibromatose de type 1 (NF1), l’imagerie systématique des voies optiques et cérébrales par IRM chez le jeune enfant sans symptôme neurologique ne semble pas justifiée dans la mesure où seules les formes symptomatiques nécessitent un traitement (recommandations PNDS 2021). En effet, une étude rétrospective portant sur 70 enfants NF1 de moins de 3 ans ayant eu une IRM systématique, répétée un an après pour plus de la moitié d’entre eux, s’est intéressée à leurs manifestations cliniques, radiologiques et moléculaires afin d’essayer de moduler ces recommandations. Malgré un effectif assez faible, elle montre que les formes les plus symptomatiques sont celles qui sont familiales en rap- port avec certains types de muta- tions ou certains domaines spécifiques du gène RAS quand il est muté, suggérant donc de concentrer le dépistage sur ces populations à risque. Néanmoins, elle met également en évidence que la progression radiologique observée dans ces formes n’est pas du tout corrélée à la progression clinique confortant également la recommandation du PNDS.
Nævus congénital : peu d’atteintes neurologiques dans les formes paucilésionnelles
Dans le nævus congénital, une récente métaanalyse portant elle aussi sur l’évaluation de la pertinence du dépistage systématique des complications neurologiques conclut, comme dans le PNDS, que ce dépistage est à discuter au cas par cas en l’absence de preuve de son intérêt pronostique. Elle rappelle la grande diversité et hétérogénéité des critères cliniques dermatologiques conduisant à ce dépistage. En revanche, dans une étude rétrospective sur dix ans chez 46 enfants ayant eu un dépistage neurologique en raison d’un nævus congénital, il apparait que les 8 enfants ayant une atteinte cérébrale mélanocytaire avaient tous des lésions multiples (< 4) indépendamment de la taille et de la topographie du nævus ; par ailleurs, chez 306 enfants avec un nævus congénital ayant eu une IRM cérébrale pour une autre raison, aucun n’avait de lésion mélanocytaire cérébrale. Ces données sont donc rassu- rantes dans les formes paucilésionnelles de nævus congénitaux.
Mélanome de l’enfant : des critères différents de celui de l’adulte
Une étude portant sur plus de 250 enfants atteints de nævus congénital unguéal, suivis 10 ans, montre que les caractéristiques dermoscopiques et les critères diagnostiques pour le diagnostic de mélanome de l’adulte ne sont pas applicables à l’enfant. En effet, les caractéristiques observées étaient comparables au mélanome de l’adulte (patron irrégulier de microlignes longitudinales) alors qu’aucun enfant de la série n’était atteint de mélanome. Il est donc capital de rassurer les parents et l’enfant devant une mélanonychie longitudinale d’allure bénigne et stable dans le temps.
Dans une série italienne de plus de 100 sujets de moins de 21 ans, les mélanomes prépubères apparaissent très rares, plus souvent nodulaires ou spitzoïdes que superficiels extensifs et ne ressemblent pas à un nævus. Dans cette série, les cas familiaux étaient plutôt des cas du très jeune adulte avec des mélanomes conventionnels alors que les cas sporadiques tendent vers des formes prépubères. Néanmoins, tous ces patients très jeunes atteints de mélanomes avérés avaient de nombreux nævus soulignant la nécessité d’une surveillance accrue chez ces sujets en sachant que les mélanomes de l’enfant prépubères sont très différents de ceux de l’adulte et nécessitent une démarche diagnostique spécifique.
Intrication barrière cutanée, microbiome et inflammation
De nombreuses études sont consacrées à cette intrication dans plusieurs pathologies au premier rang desquelles, la dermatite atopique. Une étude montre que chez des adolescents et des adultes atteints de dermatite atopique sévère, la composition lipidique de la peau ainsi que la perte d’hydratation transépidermique s’améliorent rapidement après l’institution de 15 jours de traitement par dupilumab pour tendre vers des chiffres voisins de la normale à 16 semaines de traitement suggérant une bonne restauration de la fonction barrière par le contrôle de l’inflammation. Deux fois moins d’infections cutanées sévères étaient notées dans les deux études randomisées par rapport au groupe placebo chez les patients traités par dupilumab suggérant à nouveau le rôle du bon contrôle de l’inflammation, avec l’amélioration de la fonction barrière et du microbiome dans la réduction des complications infectieuses.
Bloquer l’inflammation dans les ichtyoses
Dans le domaine des ichtyoses, une première étude de vaste criblage des marqueurs d’inflammation, de kératinisation et de prolifération par séquençage ARN sur des biopsies cutanées portant sur une cinquantaine de patients représentant les plus grands types d’ichtyoses, en comparaison avec un groupe placebo, confirme l’orientation TH-17, TH-22 dans tous les types d’ichtyoses avec une surexpression de gènes régulés par l’IL-17 et le TNF alpha, une augmentation de l’expression des gènes de kératinisation et une diminution des gènes de l’homéostasie lipidique, toutes ces anomalies étant corrélées à la sévérité clinique de la maladie. En parallèle, l’étude a observé dans tous les types d’ichtyose, une diminution de la diversité microbienne avec effondrement des bactéries lipophiliques (Cutibacterium acnes et Malassezia globosa), ainsi qu’une augmentation des staphylocoques et des corynébactéries.
En l’absence de correction possible du défect moléculaire responsable, la cible thérapeutique la plus prometteuse est, à l’heure actuelle, de réduire l’inflammation en repositionnant les nombreuses molécules disponibles actuellement dans le psoriasis.
Épidermolyse bulleuse
Dans l’épidermolyse bulleuse de l’enfant, l’intrication barrière cutanée, microbiome et inflammation joue aussi un rôle majeur : il existe en effet une diminution de la diversité bactérienne corrélée à la sévérité de la pathologie, y compris sur peau saine avec une très nette prédominance du staphylocoque, parallèle à l’élévation des marqueurs systémiques de l’inflammation. Une étude de phase II d’une innovation technologique permettant l’application sur les lésions d’un topique comportant deux séquences codantes du collagène 7 via un vecteur viral semble montrer des résultats prometteurs sur le délai de cicatrisation et sur sa durée en comparaison avec un topique placebo.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :