Cancérologie
Publié le 14 mar 2018Lecture 6 min
Perspectives thérapeutiques en cancérologie pédiatrique
François DOZ, Centre d’oncologie SIREDO, Institut Curie, Université Paris Descartes, Paris

Les progrès thérapeutiques en cancérologie pédiatrique ont été majeurs au cours des dernières décennies puisque le taux de survie à 5 ans dépasse aujourd’hui 80 % dans les pays à haut revenu. Les objectifs sont doubles : améliorer le taux de guérison, en particulier des cancers de mauvais pronostic, et diminuer les séquelles liées aux traitements, notamment ceux des cancers de bon pronostic. Les perspectives thérapeutiques actuelles concernent, d’une part, l’adaptation des traitements disponibles aux critères de risque et, d’autre part, le développement de nouveaux traitements. Les critères de risque devant être pris en compte concernent les caractéristiques individuelles de chaque patient en termes de paramètres biopathologiques tumoraux, de paramètres biologiques constitutionnels et de critères d’imageries, y compris fonctionnelles. Le développement de nouveaux traitements concerne l’ensemble des techniques thérapeutique (chirurgie, traitements médicaux, radiothérapie) et leur intégration toujours essentielle dans une pratique pluridisciplinaire.
Désescalade thérapeutique dans les maladies de bons pronostics
Les années les plus récentes ont surtout été marquées par des progrès importants dans la désescalade thérapeutique des maladies de bon pronostic, puisque de vastes études multicentriques internationales ont pu démontrer l’absence de perte de chance en diminuant l’intensité des traitements dans des groupes de patients atteints par des maladies de bas risque. Ces études vont se poursuivre dans certaines pathologies afin de continuer à limiter le risque de séquelles : diminution de la dose cumulative d’anthracyclines permettant de réduire le risque de toxicité cardiaque à long terme, diminution de la dose d’alkylants permettant de minimiser le risque d’hypofertilité ou de stérilité et diminution des doses et des volumes irradiés. D’autres moyens de désescalade thérapeutique émergent actuellement. La perspective de la taylorisation de la prescription en fonction du profil de métabolisation, et/ou de sensibilité aux risques toxiques des médicaments, est une piste aujourd’hui réaliste. Ainsi, certains profils génétiques exposent-ils plus que d’autres à la cardiotoxicité des anthracyclines ou à la toxicité auditive des dérivés du platine et pourraient être pris en compte au moment de la prescription de ces médicaments. De plus, de nouveaux antidotes de toxicité de la chimiothérapie conventionnelle commencent également à être introduits. Ainsi, le thiosulfate de sodium offre-t-il la perspective de diminuer la toxicité auditive du cisplatine avec toutefois certains résultats controversés sur le risque de diminution de l’efficacité, mais d’autres médicaments réduisant la toxicité auditive des dérivés du platine sont également en cours de développement.
Développements technologiques des traitements locaux
Les développements de la chirurgie mini-invasive, guidée par l’image et robotisée permettent d’ores et déjà de diminuer la morbidité liée aux interventions. Ces techniques initiées dans le domaine de la neurochirurgie, y compris la neuro-oncologie pédiatrique, sont aujourd’hui de plus en plus utilisées dans bien des domaines de la chirurgie (chirurgie viscérale abdominopelvienne et thoracique, chirurgie de la tête et du cou, etc.). Les nouvelles techniques de radiothérapie permettent d’optimiser l’épargne des tissus sains tout en délivrant une dose optimale au niveau des sites tumoraux. L’utilisation de la modulation d’intensité et de la tomothérapie est d’ores et déjà devenue courante et optimise la distribution de dose mais ces techniques augmentent significativement la dose intégrale, et donc théoriquement le risque de deuxième cancer. Les nouvelles techniques, comme la radiothérapie stéréotaxique ou la protonthérapie, permettent de réaliser des traitements avec une précision de l’ordre du millimètre. Cette précision nécessite une stricte immobilité, ce qui rend souvent nécessaire l’utilisation d’anesthésies générales itératives posant de nouvelles questions en termes de possibles toxicités à long terme.
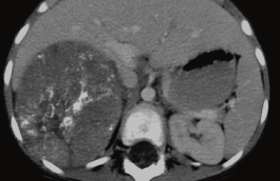
Figure 1. Exemple de chirurgie robotisée guidée par l’image d’un néphroblastome D. A : réponse à la chimiothérapie première. B : dissection vasculaire. C : exérèse tumorale.
Documents procurés par Thomas Blanc et Sabine Sarnacki (service de chirurgie viscérale infantile, hôpital Necker Enfants Malades, Université Paris Descartes).
Développement de nouveaux médicaments
En effet, les ajustements empiriques des protocoles de chimiothérapie, y compris l’utilisation de très fortes doses avec support de cellules souches hématopoïétiques, sont sans doute arrivés à leur maximum d’effet en termes de maîtrise du risque toxique et de bénéfice thérapeutique. Les développements actuels de la médecine de précision et de l’immunothérapie représentent des espoirs importants. Les premiers résultats aujourd’hui disponibles montrent déjà des bénéfices importants dans des sous-groupes de patients. Certaines maladies rares sont sensibles à des médicaments ciblant des altérations moléculaires : inhibiteurs de BCR-ABL dans les exceptionnelles leucémies myéloïdes chroniques de l’enfant ou certaines formes rares mais graves de leucémies aigues lymphoblastiques ; inhibiteurs de NTRK dans certains cas de fibrosarcomes infantiles envahissants ou inhibiteurs de ALK dans les tumeurs myofibroblastiques inflammatoires et certains neuroblastomes ou lymphomes anaplasiques à grandes cellules. D’autres traitements ciblant des altérations de récepteurs thyrosine kinase et de voies de signalisation sont en cours de développement dans des maladies moins rares. L’altération de la voie des MAP-kinases est un élément fondateur de la très grande majorité des tumeurs gliales de bas grade de l’enfant et les résultats obtenus avec les inhibiteurs de BRAF (en cas de mutation V600E de BRAF) ou les inhibiteurs de MEK (en cas de duplication KIAA- BRAF) sont suffisamment encourageants pour envisager d’utiliser ces médicaments en première ligne dans des essais thérapeutiques multicentriques internationaux, en comparaison à la chimiothérapie empirique actuellement préconisée et dont le niveau de preuve d’efficacité sur le plan fonctionnel reste relativement limité. Cela soulève la question difficile de développement de nouveaux médicaments dans les maladies dont le pronostic vital est souvent bon, mais pour lesquelles des progrès doivent être accomplis afin de diminuer le risque de séquelles liées à la maladie et ses traitements.
Figure 2. Dosimétrie comparative entre les différentes techniques d’irradiation. Exemple de l’irradiation d’un cas de craniopharyngiome. L’irradiation par protons protège au maximum les tissus sains.
Documents procurés par Claire Alapetite (département de radiothérapie, Institut Curie, Paris).
Les premières évaluations de l’immunothérapie en cancérologie pédiatrique ont concerné les inhibiteurs de checkpoint immunologique (anti-PD1, anti-PDL1) avec des résultats importants dans la maladie de Hodgkin en rechute ou réfractaire (en suivant en cela les résultats obtenus chez l’adulte) et dans des maladies rares avec anomalies de la réparation de l’ADN, aboutissant à de nombreuses néo-mutations au sein des cellules tumorales, et donc à l’expression de nombreux néo-antigènes à l’origine sans doute de l’efficacité de ces nouveaux médicaments. De même, le développement des CAR-T cells aboutit déjà à des résultats spectaculaires dans certains cas très graves de leucémies aigües lymphoblastiques réfractaires et ces techniques complexes pourraient aussi prochainement être utilisées en ciblant d’autres antigènes tumoraux, y compris de tumeurs solides.
D’autres nouvelles approches sont aujourd’hui ébauchées (ciblage des altérations épigénétiques, des anomalies de réparation de l’ADN, de la régulation du cycle cellulaire, utilisation des immunomodulateurs, etc.) et d’autres pourront encore se développer à partir de découvertes plus fondamentales, par exemple sur le rôle des cellules stromales du microenvironnement tumoral.
Conclusion
Les perspectives thérapeutiques en oncologie pédiatrique sont multiples. Elles nécessitent des explorations biopathologiques complexes des tumeurs et des individus. Elles nécessitent également à chaque étape une évaluation rigoureuse dans le cadre d’essais thérapeutiques multicentriques internationaux. Le partenariat avec les parents et les patients est essentiel pour promouvoir ces développements et les réaliser dans de bonnes conditions éthiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :