Publié le 02 mai 2011Lecture 9 min
Prise en charge des infections materno-foetales en maternité, encore et toujours…
S. PARAT, Maternité Port-Royal, hôpital Saint-Vincent de Paul, Paris
Les infections materno-foetales (IMF) sont la plupart du temps surtout chez le nouveau-né à terme d’excellent pronostic. Encore faut-il les dépister tôt. Leur fréquence, variable en fonction du taux de prématurité et donc du type de maternité, est estimée entre 0,5 et 1 %. La difficulté consiste à traiter à temps une IMF sans traiter à tort trop de nouveau-nés.
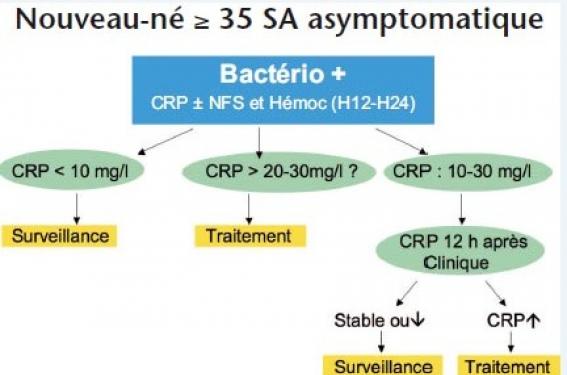
Définition En maternité, l’infection maternofoetale (IMF) survient généralement dans les premières 72 heures de vie et est donc dite précoce. Elle est certaine lorsqu’une bactérie a été isolée dans l’hémoculture et/ou le liquide céphalorachidien (LCR). Elle est dite probable lorsqu’une bactérie a été isolée dans les prélèvements périphériques et qu’il existe des signes cliniques et/ou des signes biologiques d’infection. Diagnostic La démarche diagnostique s’appuie sur l’analyse de l’anamnèse obstétricale, la recherche de signes cliniques et les résultats bactériologiques. Un bilan inflammatoire complémentaire est parfois demandé. L’anamnèse obstétricale La connaissance de l’anamnèse obstétricale permet de repérer les nouveau-nés à risque d’infection et de pratiquer au minimum dès la naissance des prélèvements bactériologiques. Certains nouveau- nés infectés n’auront néanmoins aucun facteur de risque. L’ANAES a défini en 2002 des critères majeurs et mineurs d’IMF. • Les critères majeurs sont : – l’existence d’une chorioamniotite ; – la connaissance d’un jumeau infecté ; – une fièvre avant ou en début de travail supérieure à 38 °C ; – une rupture de la poche des eaux (RPDE) supérieure à 18 h ; – une prématurité inférieure à 35 SA ; – l’existence d’un antécédent de nouveau-né infecté par le streptocoque B ou d’un prélèvement vaginal positif à streptocoque B, associés à l’absence de prophylaxie complète par bêtalactamines pendant le travail (C3g). Les deux premiers critères indiquent une antibiothérapie immédiate. Les autres critères, s’ils sont associés, sont à haut risque d’infection (encadré). • Les critères mineurs d’infection sont représentés par une rupture de la poche des eaux (RPDE) supérieure à 12 h et inférieure à 18 h ; une prématurité inférieure à 37 SA, mais supérieure à 35 SA ; un liquide amniotique méconial ; une fièvre pendant le travail ; des anomalies du rythme cardiaque foetal et/ou une mauvaise adaptation néonatale mal expliquées. Ces situations sont plus fréquentes que les premières et donc moins spécifiques. Les signes cliniques Tout signe clinique chez un nouveau- né peut révéler une infection, ce qui signifie qu’aucun n’est spécifique. En cas de gravité de l’état clinique, une antibiothérapie est débutée en urgence après prélèvement du bilan infectieux. Tout signe clinique chez un nouveau-né peut révéler une infection. Les examens bactériologiques et biologiques Les prélèvements bactériologiques comprennent au minimum le prélèvement du liquide gastrique et en général deux autres sites, dont l’oreille. La multiplication des sites au-delà de trois n’améliore pas les performances diagnostiques. Ils sont pratiqués dès la naissance en cas d’anamnèse obstétricale ou de signes cliniques. En cas d’éléments évocateurs de listériose maternelle, la bactériologie du placenta est demandée. La multiplication des sites de prélèvement au-delà de trois n’améliore pas les performances diagnostiques. L’examen direct du liquide gastrique doit être interprété en tenant compte de la contamination normale des prélèvements par la flore maternelle. Sa performance dépend de l’expérience du bactériologiste. L’existence de polynucléaires à l’examen direct n’est pas un élément prédictif d’infection. La valeur prédictive négative de l’examen direct du gastrique est bonne vis-à-vis des cocci gram positifs. Les cultures bactériologiques ont une excellente valeur prédictive négative, dont on tient compte pour arrêter secondairement un traitement antibiotique débuté à la naissance. L’existence d’entérobactéries aux cultures des prélèvements périphériques doit être interprétée en tenant compte de l’aspect monomorphe des prélèvements et du contexte clinique. Une colonisation isolée du nouveau-né bien portant est confirmée par l’absence de syndrome inflammatoire et ne nécessite alors pas d’antibiothérapie sauf germes à haut pouvoir pathogène : listéria, pneumocoques et Hæmophilus influenzæ. Les autres colonisations, en particulier à streptocoques B, sont simplement notées dans le carnet de santé en rappelant aux parents la nécessité de consulter devant toute fièvre dans les 3 premiers mois. La colonisation d’un nouveauné ne nécessite pas de traitement, sauf colonisation par la listéria, le pneumocoque et l’Hæmophilus influenzæ. L’hémoculture est prélevée systématiquement avant de débuter une antibiothérapie et devant un syndrome inflammatoire. Elle est précédée d’une désinfection cutanée soigneuse, car la peau peut être fortement colonisée. La quantité de sang prélevée est d’au moins 1 ml, au mieux 2 ml pour optimiser les chances d’isoler un germe. Lorsqu’elle est négative en 36 heures, elle a toute chance de le rester. La ponction lombaire garde quelques indications chez le nouveau- né à terme : anomalie de l’examen neurologique, hémoculture positive ou signe de sepsis, absence de diminution de la C-réactive protéine (CRP) sous traitement. Elle est pratiquée chez un enfant stable. L’examen cytobactériologique des urines n’a pas d’intérêt à cet âge de vie. • La recherche d’un syndrome inflammatoire est pratiquée lorsqu’il existe des signes cliniques d’infection, une colonisation ou dans les premières 24 heures de vie devant une anamnèse infectieuse lourde chez un enfant non traité. En cas de mise sous antibiotique de façon précoce, l’analyse du syndrome inflammatoire dans les premières 48 heures associée à la bactériologie permettra ou non de confirmer l’infection. • La numération formule sanguine est peu utile, car les anomalies les plus spécifiques (neutropénie, thrombopénie) sont rares chez l’enfant asymptomatique. Autres examens L’interleukine 6 est un marqueur précoce d’infection des premières 12 heures, mais cet examen n’est pas encore de pratique courante. La CRP est donc à l’heure actuelle l’examen biologique le plus utile, en sachant que son élévation ne débute que 8 à 12 heures après le début de l’infection. Figure 1. Conduite à tenir chez le nouveau-né ≥ 35 SA asymptomatique. Sa sensibilité s’élève entre 12 et 24 heures de vie (83 et 98 %). Sa valeur prédictive négative est excellente, ce qui permet d’exclure une infection lorsque 2 CRP restent négatives entre 24 et 36 heures de vie. Elle peut être faussement positive en cas de liquide amniotique méconial, de contusions, etc. Les conduites à tenir devant un enfant asymptomatique avec bactériologie périphérique positive et chez un enfant présentant des signes cliniques d’infection sont résumées dans les figures 1 et 2. La CRP est un outil majeur du diagnostic d’IMF. Elle ne s’élève que 8 à 12 h après le début de l’infection. Deux CRP négatives entre 24 et 36 h excluent une IMF. Traitement L’antibiothérapie est adaptée aux examens bactériologiques directs de l’enfant ou à la bactériologie maternelle quand ils sont positifs. En l’absence d’orientation bactériologique, le choix du traitement sera basé sur un « pari raisonné ». Bien que plus rares du fait des mesures prophylactiques, les IMF à streptocoque B restent encore majoritaires chez le nouveau-né à terme. En l’absence d’orientation bactériologique, le choix du traitement sera basé sur un « pari raisonné ». En maternité, où la majorité des enfants sont asymptomatiques, la bithérapie par ampicilline et aminoside est donc le plus souvent prescrite, malgré l’augmentation connue de la résistance de l’Escherichia coli. Les aminosides, dont l’action est concentration-dépendante, sont injectés une fois par 24 h chez le nouveau-né à terme. Une purge entre les deux antibiotiques est nécessaire afin d’éviter leur inactivation. Les indications d’une trithérapie ajoutant le céfotaxime, sont un état clinique préoccupant avec signes de sepsis ou des signes neurologiques, qui invitent à doubler les doses de bêtalactamines. Figure 2. Conduite à tenir chez le nouveau-né symptomatique. Dans tous les cas, les antibiotiques sont adaptés secondairement au résultat de la culture et de l’antibiogramme. L’administration intraveineuse des antibiotiques a été beaucoup facilitée par l’utilisation des cathlons bouchés. L’administration intraveineuse des antibiotiques a été beaucoup facilitée par l’utilisation des cathlons bouchés. La voie per os ne peut actuellement être recommandée, bien que les concentrations plasmatiques atteintes par la prescription de 40 mg/kg/12 h per os d’amoxicilline chez des enfants colonisés, aient montrées leur supériorité par rapport aux CMI des germes habituellement sensibles dans les IMF. Une étude clinique chez 30 enfants présentant une IMF asymptomatique à streptocoque B et traités après 48 h de traitement intraveineux par 300 mg/kg/j de clamoxyl per os, n’a pas montré de mauvaise tolérance ni de rechute infectieuse. Les inconnues en termes de tolérance, risque à moyen et long termes, modification de la flore digestive, ne permettent actuellement pas de valider ce type d’administration (Anaes). Les aminosides sont arrêtés après 2 injections à 24 h d’intervalle chez le nouveau-né à terme. La durée du reste du traitement est de 8 jours pour une infection avec hémoculture positive. Pour les infections probables, le traitement est poursuivi jusqu’à disparition des signes cliniques et négativation de la CRP. La persistance d’une CRP élevée doit faire rechercher un foyer infectieux secondaire (articulaire, méningé, etc.). Conclusion Le dépistage et le traitement des infections materno-foetales repose sur des protocoles précis, rigoureux, connus et suivis de tous les intervenants médicaux. L’absence d’innocuité des traitements antibiotiques en termes de déséquilibre de la flore digestive du nouveau-né et d’acquisition de résistance, doit faire peser soigneusement le risque infectieux avant de débuter une antibiothérapie chez un enfant asymptomatique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :