Publié le 20 aoû 2012Lecture 6 min
Anomalies des spermatozoïdes, développement embryonnaire et devenir des enfants
N.-G. CASSUTO, Unité AMP Drouot et Bleuets Diaconesses, Paris
L’étude des paramètres spermatiques est indispensable dans le bilan de l’état de fertilité du couple. En effet, la numération, la vitalité, l’analyse de la mobilité progressive des spermatozoïdes et du spermocytogramme dans un éjaculat sont essentiels eu égard aux arguments thérapeutiques éventuellement proposés. L’avènement de l’injection intracytoplasmique d’un spermatozoïde (ICSI) en 1992 a permis l’obtention de grossesses avec des spermes très altérés, ou d’origine testiculaire. Alors que les biologistes pensaient que le spermatozoïde n’était qu’un vecteur du génome paternel et que seul l’ovocyte organisait le développement de l’embryon grâce à ses transcrits, de nombreux travaux ont authentifié un effet paternel indéniable sur le développement embryonnaire précoce.
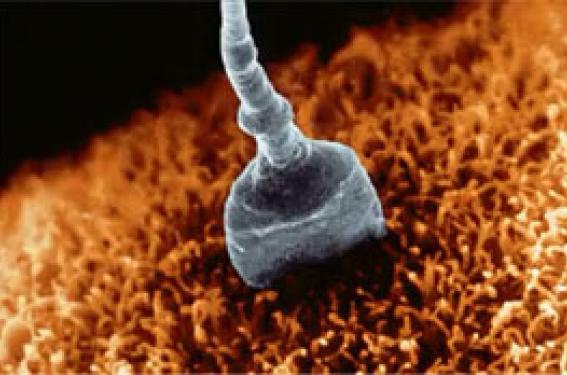
Illustration : Le même spermatozoïde de score 0 à x 400 et à x 6100 dont les anomalies ne sont visibles qu’au fort grossissement. Nouvel outil, nouvelles anomalies Quand le moment du choix du spermatozoïde à injecter se pose au biologiste, comment choisir ? Quels sont les arguments de la décision ? Le microscope inversé en contraste de phase de type Nomarski permet d’observer le spermatozoïde à x 6 600, voire à x 9 900 en fonction de la taille de l’écran. À un tel grossissement, un examen plus précis de la tête et du noyau spermatique du spermatozoïde avant microinjection permet d’écarter les spermatozoïdes les plus altérés (1). Mise en place d’une classification : le score HVB Nous avons voulu mettre en évidence l’impact de la morphologie du spermatozoïde en réalisant une analyse prospective du retentissement des anomalies de la tête et du noyau spermatique. Notre étude a permis, après une analyse statistique multivariée, de définir 3 critères discriminants en termes de fécondation et surtout de potentiel évolutif des embryons : la tête (H), la base (B) et les vacuoles (V) avec une cotation de chaque anomalie. H = 2 points pour la tête, B = 1 point pour la base et V = 3 points pour la vacuole. Le score obtenu pour chaque spermatozoïde varie ainsi de 0 pour les plus anormaux à 6 points pour les « tops » normaux. Nous n’avons obtenu aucun blastocyste expansé lorsqu’un spermatozoïde de score 0 a été injecté. Nous avons essayé de comprendre pourquoi. Y a-t-il une corrélation entre les anomalies de l’ADN spermatique et la morphologie de la tête du spermatozoïde ? En d’autres termes, est-ce que les spermatozoïdes du score 0 sélectionnés au fort grossissement (x 6 100) sont porteurs d’altérations de l’ADN, bloquant le développement précoce de l’embryon ? S’agit-il d’une anomalie chromosomique ? Pour y répondre nous avons tenté d’évaluer par hybridation in situ (FISH) chez des hommes porteurs d’une translocation réciproque ou robertsonienne, en fonction de notre classification à fort grossissement, la teneur chromosomique des spermatozoïdes. Cette étude n’a montré aucune différence statistiquement significative entre les taux de mode de ségrégation des spermatozoïdes sélectionnés versus ceux non sélectionnés (2). L'observation au fort grossissement ne peut pas être un moyen de distinguer les spermatozoïdes normaux de ceux porteurs d’une anomalie chromosomique. Fragmentation de l’ADN ou anomalie de condensation de la chromatine ? Nous avons analysé 10 400 spermatozoïdes provenant de 26 patients inclus dans un programme d’ICSI. Nous avons comparé les taux de fragmentation de l'ADN et de décondensation de chromatine des spermatozoïdes en fonction de la morphologie de la tête au fort grossissement et plus précisément avec le score 0. Une corrélation négative a été montrée entre les paramètres du spermogramme et le score 0 : pour la concentration (r = -0,41, p = 0,03), la motilité (r = -0,42, p = 0,03) et surtout pour la morphologie (r = -0,63, p = 0,0008). Aucune corrélation n'a été trouvée avec le taux de fragmentation de l'ADN ; en revanche, une forte corrélation entre le score 0 et le taux de décondensation chromatine a été mise en évidence (p < 0,0001) (3). Le score 0 ne doit pas être sélectionné pour l'ICSI car ces spermatozoïdes ont une chromatine moins bien condensée, plus immature, car plus riche en histones. Ces spermatozoïdes avec leur ADN défectueux, dû à leur chromatine décondensée, auront un génome paternel plus exposé et donc plus fragile aux phénomènes d’apoptose et aux facteurs environnementaux au cours de leur évolution dans le tractus génital masculin et féminin. Quelles sont les conséquences de l’injection de ces spermatozoïdes à chromatine décondensée ? Pour cela, nous avons comparé le suivi de cohortes d'enfants nés par deux différentes techniques de choix du spermatozoïde : l’ICSI, ne permettant pas d’identifier et d’écarter le score 0 (non évaluable au grossissement x 400), et l’IMSI, qui permet une meilleure vision de la tête du spermatozoïde conduisant à éliminer ceux dont la chromatine est altérée. Cette étude prospective a été réalisée de 2005 à 2010 sur 1 028 enfants nés : 578 (56 %) conçus après ICSI et 450 (44 %) après IMSI en choisissant les spermatozoïdes en fonction de l’application stricte de notre classification et en éliminant les spermatozoïdes de score 0. Les données médicales des bébés nés vivants ont été recueillies dès la naissance jusqu’à l’âge de 3 ans. Le pourcentage de perdus de vue était de 1,09 %. Nous avons exclu les femmes de plus de 39 ans, les spermes congelés, épididymaires et testiculaires. Les deux groupes sont similaires pour la distribution de l'âge des femmes et des hommes. Les deux bras sont totalement identiques au niveau des traitements utilisés, du nombre d’ovocytes recueillis, du nombre moyen d’embryons transférés ; seul le taux de fécondation s’est révélé différent et plus élevé en IMSI. Aucune différence significative en termes de grossesses interrompues du fait de malformations foetales ou de troubles génétiques n’a été constatée entre les deux groupes. Cependant, le nombre de malformations majeures et de maladies génétiques classées par un généticien indépendant montre une différence significative entre les deux groupes : 24 en ICSI (4,15 %) contre 8 en IMSI (1,77 %) (X-square = 4,73, p = 0,031) test de Fisher (p = 0,030) ; les malformations affectant principalement le système uro-génital (4). Conclusion Nos travaux mettent en exergue l’importance d’un examen plus précis du sperme et plus particulièrement du spermatozoïde. Aujourd’hui, les données d’un spermocytogramme standard sont nécessaires, mais ne sont pas suffisamment discriminantes. L’exploration de l’infertilité doit inclure la fragmentation de l’ADN spermatique (N < 15 %), de la décondensation de la chromatine (N < 25 %) et du taux de spermatozoïdes de score 0 dans la fraction migrée du sperme (N < 45 %). Ces paramètres permettent d’orienter le biologiste dans le choix de la technique ICSI ou IMSI et de choisir le spermatozoïde à injecter afin de réduire le taux de malformations majeures.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :